Introduction
Le facteur nucléaire kappa B (NF-kB) est un ancien facteur de transcription protéique (Salminen et al., 2008) et considéré comme un régulateur de l’immunité innée (Baltimore, 2009). La voie de signalisation NF-kB relie les signaux pathogènes et les signaux de danger cellulaire organisant ainsi la résistance cellulaire aux agents pathogènes envahissants., En fait, une pléthore d’études ont montré que NF-kB est un centre de réseau responsable de la signalisation biologique complexe (Albensi et Mattson, 2000; Kaltschmidt et Kaltschmidt, 2009; Karin, 2009). À cette fin, on a émis l’hypothèse que le NF-kB était un régulateur principal des cascades biochimiques conservées de manière évolutive (Mattson et al., 2000). D’autres facteurs sont également transférés dans les mitochondries et sont impliqués dans la modulation de l’expression (Barshad et coll., 2018a), mais ne sont pas au centre de cette revue., Le but de cette revue est de tenter de comprendre comment l’activité NF-kB contribue à la fonction mitochondriale. On suppose que le lecteur a déjà une compréhension de la biologie mitochondriale de base. Dans le cas d’une étude plus approfondie, le lecteur est renvoyé à de nombreuses études et revues excellentes sur la structure et la fonction mitochondriales (Hall, 1979; Fox, 1982; Roger et Silberman, 2002; Henze et Martin, 2003; Conradt, 2006; Ettema, 2016; Wang et Youle, 2016; Barshad et al., 2018b).,
Activation NF-kB
Les sous-unités du facteur nucléaire kappa B, comprenant le complexe NF-kB, sont exprimées à la fois dans les neurones et dans la glie. Le complexe NF-kB existe dans un état inactif dans le cytoplasme (Ghosh et al., 1998; Aggarwal et coll., 2004; Hayden et Ghosh, 2004) où l’activation du NF-kB a été bien décrite (Li et Karin, 2000; Baud et Jacque, 2008; Israel, 2010). Lorsqu’il est stimulé par des molécules telles que le TNFa ou d’autres facteurs de stress cellulaires, le TNFa se lie aux récepteurs du TNF (Figure 1)., Cette liaison, via plusieurs étapes intermédiaires, conduit à une interaction avec le complexe IkB kinase (IKK), qui conduit ensuite à la phosphorylation de IkB, et entraîne par la suite L’ubiquitination et la dégradation de IkB. Une fois dégradé, le dimère NF-kB restant (par exemple, les sous-unités p65/p50) se déplace vers le noyau, où il se lie à la séquence de consensus de L’ADN de divers gènes cibles. La sélectivité de la réponse NF-kB est basée sur plusieurs facteurs (Sen et Smale, 2010), y compris la composition des dimères, le moment et le type de cellule., L’influence du NF-kB sur la survie cellulaire est également complexe et peut être neuroprotectrice ou proinflammatoire, selon le type de cellule, le stade de développement et l’état pathologique (Qin et al., 2007).
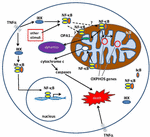
la Figure 1. Des voies pour le facteur Nucléaire kappa B (NF-kB) de signalisation dans le cytoplasme et les mitochondries. Le complexe tri-subunt NF-kB (p. ex., P65, p50, IkB – une combinaison possible) existe à l’état inactif dans le cytoplasme. L’activation du NF-kB est initiée lorsque des molécules telles que le TNFa se lient aux récepteurs du TNF (différents types existent)., D’autres stimuli externes ou internes peuvent également activer NF-kB. Un processus compliqué de transduction du signal commence alors une fois que les récepteurs TNF sont activés; IkB kinase (IKK) est finalement déclenché et conduit à la phosphorylation de IkB, ce qui entraîne L’ubiquitination et la dégradation IkB. Une fois IkB dégradé, le dimère NF-kB restant (par exemple, des combinaisons de sous-unités p65/p50 ou p50/p50 sont possibles) se déplace vers le noyau, où il se lie à une séquence consensuelle D’ADN de gènes cibles., Par des processus mal compris, le complexe NF-kB ou les sous-unités NF-kB peuvent également migrer dans la mitochondrie, où les preuves suggèrent qu’il occupe l’espace intermembranaire. Une fois à l’intérieur des mitochondries, on pense que NF-kB interagit avec les gènes OXPHOS (ADNmt mitochondrial) qui mènent à l’expression de protéines impliquées dans diverses fonctions, y compris la dynamique mitochondriale et la régulation de la COX III (composant du complexe IV)., Les preuves suggèrent également que le NF-kB peut fonctionner comme un commutateur dans les mitochondries et contrôler l’équilibre entre l’utilisation de la glycolyse cytoplasmique et la respiration mitochondriale dans les cellules normales et dans le cancer. Enfin, les données indiquent également une stimulation intrinsèque de la voie apoptotique, où l’activation de NF-kB dans les mitochondries conduit à la libération du cytochrome c, déclenchant ainsi des cascades de caspases et une mort cellulaire programmée.,
Sur le plan organisationnel, NF-kB est un facteur de transcription de la famille Rel et est associé à cinq gènes, NF-kB1, NF-KB2, RELA, RELB et REL (Chen et Greene, 2004); ces gènes codent plusieurs protéines, NF-kB1, NF-kB2, RelA, RelB et c-Rel, respectivement, où les protéines sont de grandes protéines précurseurs connues sous le nom de P105 et P100 qui subissent une protéolyse pour devenir P50 et P52, respectivement. Ces protéines contiennent des domaines d’homologie REL (RHD) à leur région amino-terminale; la région RHD est composée de 2 domaines distincts, mais adjacents., La séquence la plus éloignée de la région carboxy-terminale permet à la protéine de se lier à L’ADN. Une séquence plus intérieure permet aux protéines de la famille Rel de se dimériser (homo – ou hétérodimères) pour la suppression de l’expression via la liaison de leur famille correspondante d’inhibiteurs, les protéines IkB (Chen et Greene, 2004). Cette dernière séquence comprend la séquence de localisation nucléaire (NLS) qui devient démasquée lorsque IkB est délié par dégradation. Le NLS a pour tâche de guider ou de marquer les protéines actives en vue de leur importation dans le noyau cellulaire (Chen et Greene, 2004; Karin et al., 2004; Barger et coll.,, 2005).
Trois de ces protéines (RelA, RelB et c-REL) codent également un domaine de transactivation (TADs) dans leur région carboxy-terminale. Les TADs permettent à ces protéines d’interagir avec l’appareil de transcription basal, connu sous le nom de protéine de liaison TATA (TBP), facteur de Transcription IIB, ainsi que les co-activateurs transcriptionnels de la protéine de liaison P300 et cAMP response element (CREB) (CBP) (Chen et Greene, 2004)., Seules ces trois protéines sont capables d’induire la transcription de leurs régions codant L’ADN tandis que les autres protéines, les homodimères p50 et p52, sont capables d’occuper les sites de liaison à l’ADN sans initier la transcription. Compte tenu de cela, les 2 dernières protéines homodimères de p50 et p52 agissent comme des répresseurs transcriptionnels (Chen et Greene, 2004).
Les homodimères p105 et p100 occupent des sites de liaison à L’ADN bloquant ainsi la transcription via des facteurs de transcription qui possèdent des tad (Barger et al., 2005). Une troisième forme de répression transcriptionnelle est due aux protéines IkB., Ces protéines ont plusieurs répétitions d’ankyrine comme domaine central et fonctionnent en se liant à la RHD qui masque la NLS (Karin et al., 2004). Sans NLS actif, les protéines NF-kB sont limitées au cytoplasme et sont incapables de migrer dans le noyau et donc la transcription est bloquée.
NF-kB Est Trouvé dans les Mitochondries
En 2001, une étude réalisée par Bottaro et coll. (2001) ont trouvé IkBa et la sous-unité NF-kB p65 dans des fractions subcellulaires et des mitochondries purifiées à partir de cellules Jurkat. Les cellules Jurkat sont une lignée cellulaire immortalisée de cellules lymphocytaires T humaines utilisées pour étudier la leucémie., Dans L’étude de Bottero, il a été déterminé que IkBa et NF-kB p65 étaient localisés dans l’espace intermembranaire mitochondrial. L’espace intermembranaire mitochondrial est l’espace qui existe entre la membrane mitochondriale interne (IMM) et la membrane mitochondriale externe (OMM).
par la suite, Cogswell et coll. (2003) ont également montré que des sous-unités NF-kB, p50 et p65, et IkBa, ont été trouvées dans les mitochondries. Pour le déterminer, plusieurs méthodes ont été utilisées pour fournir des preuves, y compris la microscopie électronique de sections de cellules U937., Les cellules U937 ont d’abord été isolées du lymphome d’un patient masculin d’âge moyen pour étudier le comportement et la différenciation des monocytes. Ici Cogswell et coll. (2003) ont pu visualiser les sous-unités NF-kB p50 et P65 et IkBa dans la matrice interne des mitochondries. Des cellules hépatiques de Rat ont également été examinées dans cette étude et la sous-unité p50 et la sous-unité IkBa ont également été identifiées. De plus, les cellules U937 ont été stimulées pendant 1 h par le TNFa, un déclencheur connu de la voie de signalisation NF-kB., Dans cette expérience, des analyses Western blot dans des fractions mitochondriales et cytoplasmiques ont révélé que le traitement par le TNFa entraînait une perte D’IkBa dans les compartiments mitochondrial et cytoplasmique 30 min après le traitement, ce qui suggère que L’IkBa était dégradé. L’analyse EMSA, un test in vitro qui détecte l’activation du NF-kB et la liaison non spécifique aux séquences D’ADN, a également été réalisée sur des protéines prélevées à partir d’extraits nucléaires de mitochondries isolées de cellules U937 stimulées par le TNFa., Ici, ils ont déterminé que la signalisation TNFa a conduit à une augmentation de l’activité de liaison à l’ADN de NF-kB p50, dans la protéine prélevée dans les mitochondries.
D’autres études ont également détecté du NF-kB dans les mitochondries. Ceux-ci comprennent des études (Guseva et al., 2004; Zamora et coll., 2004) dans les lignées cellulaires HT1080 des fibroblastes humains, les lignées cellulaires LNCaP et PC3 de la prostate humaine et les cellules HeLa. Dans les cellules LNCaP, des sous-unités mitochondriales NF-kB p50 et p65 ont été trouvées liées à L’ADN mitochondrial (ADNmt)., Prises ensemble, ces études montrent des preuves pour la signalisation NF-kB dans les mitochondries et que NF-kB régule l’expression des ARNm mitochondriaux (voir la section NF-kB et expression des gènes mitochondriaux ci-dessous).
NF-kB contrôle la dynamique mitochondriale
Il existe plusieurs protéines impliquées dans la dynamique (fission et fusion) et la morphologie des mitochondries (Karbowski et Youle, 2003; Olichon et al., 2006; Brooks et Dong, 2007; Song et coll., 2008; Autret et Martin, 2010; Silva et coll., 2013; Sinha et Manoj, 2019). L’un d’eux est la protéine optic atrophy 1 (OPA1) (Olichon et al.,, 2006; Garcia et coll., 2018; Lee et Yoon, 2018). Des études ont suggéré que L’OPA1 est un régulateur de la fusion de la membrane interne mitochondriale et également du remodelage du cristae mitochondrial (Cipolat et al., 2006). Récemment Laforge et coll. (2016) ont montré que L’absence D’IKKa avait un impact sur L’expression D’OPA1 dans les mitochondries et sur la morphologie mitochondriale.
Étonnamment, dans une étude récente de Nan et coll. (2017), il a été constaté que la stimulation du récepteur TNFa 2 (TNFR2) favorisait la fusion mitochondriale via l’activation dépendante de la NF-kB de L’expression D’OPA1 dans les myocytes cardiaques., Fait important, l’activation du TNFR2 dans cette étude a protégé les myocytes cardiaques contre le stress en régulant à la hausse L’expression D’OPA1. L’administration de faibles concentrations de TNFa exogène (0,5 ng/mL) avant l’ischémie-reperfusion semble améliorer la survie cellulaire, alors que des concentrations plus élevées (10-20 ng/mL) entraînent des effets toxiques dans les cellules.
NF-kB et apoptose dans les mitochondries
Le rôle des mitochondries dans la mort cellulaire programmée, ou apoptose, est connu depuis un certain temps (Green et Reed, 1998; Wang et Chen, 2015)., Le rôle le plus important pour les mitochondries est la génération D’ATP; cependant, la deuxième fonction la plus importante pour les mitochondries est probablement dans le contrôle de la mort cellulaire. Comment la mitochondrie fait-elle cela? Si la mitochondrie ne parvient pas à déclencher la mort cellulaire, le cancer en est souvent la conséquence. Ainsi, afin de réguler la mort cellulaire, les mitochondries intègrent des signaux provenant de diverses sources, connues sous le nom de voies intrinsèques de l’apoptose. Les composants de L’activité NF-kB semblent être l’un de ces signaux, bien que le TNFa, un activateur de NF-kB, fasse partie d’une voie extrinsèque de l’apoptose., Les voies extrinsèques (médiées par les récepteurs de la mort) sont initiées à l’extérieur de la cellule, tandis que les voies intrinsèques de l’apoptose sont médiées et déclenchées dans les mitochondries.
dans une étude récente de Pazarentzos et al. (2014), L’IkBa exerce une activité pro-apoptotique en inhibant L’anti-apoptotique NF-kB. Dans la plupart des cellules, l’activation de NF-kB conduit à l’expression du gène cible en aval qui déclenche la résistance à la mort cellulaire (Luo et al., 2005). Dans cette étude, il a été démontré qu’une nouvelle fonction d’apoptose était due à IkBa, la sous-unité qui inhibe l’activation de NF-kB. Pazarentzos et coll., (2014) ont constaté que IkBa se localise à L’OMM où il interagit avec un canal d’anions dépendant de la tension (VDAC) et l’hexokinase II mitochondriale (HKII) pour stabiliser ce complexe et empêcher la libération du cytochrome C par Bax pour l’apoptose. Bax est un membre de la famille des protéines Bcl-2, qui se sont avérées être des régulateurs de la mort cellulaire programmée (Karbowski et al., 2006).
D’autres études ont également fait allusion au rôle du NF-kB dans la régulation plus directe de l’apoptose dans la mitochondrie. Dans une étude de Liu et coll., (2004), l’inhibition du NF-kB seul dans les macrophages a entraîné la libération du cytochrome C. rappelons que le cytochrome c est responsable de la navette des électrons du complexe III au complexe IV et que la libération du cytochrome C dans le cytoplasme, un activateur des caspases, est une étape clé dans le déclenchement de l’apoptose.
NF-kB et Respiration mitochondriale
le facteur nucléaire kappa B a été démontré dans de nombreuses études pour favoriser la tumorigenèse. Comment cela se produit n’était pas exactement clair. Dans une étude révolutionnaire de Mauro et al., (2011), NF-kB a été trouvé pour réguler à la hausse la respiration mitochondriale dans les cellules du carcinome du côlon. Ici, ils ont établi que cette fonction de NF-kB supprime l’effet Warburg. Rappelons que l’effet Warburg (Vander Heiden et coll., 2009) décrit l’observation selon laquelle les cellules cancéreuses ont tendance à favoriser le métabolisme par glycolyse plutôt que par la voie de phosphorylation oxydative plus efficace. Ainsi, dans cette étude, les auteurs ont déterminé que NF-kB organise les réseaux de métabolisme énergétique en contrôlant l’équilibre entre l’utilisation de la glycolyse et la respiration mitochondriale., Fait intéressant, ils ont trouvé un rôle pour NF-kB dans l’adaptation métabolique dans les cellules normales et dans le cancer. Leurs résultats suggèrent en outre que la suppression du métabolisme mitochondrial dans les cellules cancéreuses établies par inhibition de la NF-kB et de la metformine diminue la tumorigenèse.
NF-kB et Expression des gènes mitochondriaux
Le facteur nucléaire kappa B est un régulateur connu de l’expression des gènes – à la fois négativement et positivement (Mattson et al., 2000). Cependant, la façon dont le NF-kB régule ou influence l’expression des gènes mitochondriaux codés nucléaires est moins comprise., L’ADNmt humain possède 37 gènes codant pour 13 polypeptides. Il a été démontré que les gènes de l’ADNmt codent pour plusieurs des sous-unités des 5 complexes de la chaîne de transport d’électrons (ETC), 2 ARNr et 22 ARNt. Cependant, la plupart des sous-unités ETC sont codées par L’ADN nucléaire, ce qui pourrait être influencé par l’activité NF-kB (Calvo et al., 2016).
Par exemple, il a été affirmé (Cogswell et coll., 2003) que la voie NF-kB peut réguler négativement l’expression des gènes mitochondriaux associés à la sous-unité COX III., La sous-unité COX III est codée par l’ADNmt et est une composante du complexe IV dans la mitochondrie etc. Il fonctionne comme une sous-unité catalytique dans le complexe IV, qui est le complexe associé à la consommation d’oxygène mitochondrial. Dans une étude de Cogswell et al. (2003), la modulation de l’activation du NF-kB a entraîné la perte d’expression de L’ARNm de COX III et du cytochrome B. D’autres études soutiennent un rôle pour NF-kB régulant des gènes mitochondriaux supplémentaires, tels que COX I, et Cytb (Psarra et Sekeris, 2008, 2009; Barshad et al., 2018b)., De plus, la sous-unité NF-kB p65 a réduit les niveaux d’ARNm CytB codés par l’ADNmt, peut-être en se liant à la boucle D dans les cellules humaines en l’absence de p53 (Johnson et al., 2011). Dans l’ensemble, ces résultats suggèrent que la signalisation NF-kB peut influencer l’activité enzymatique des complexes ETC respiratoires.
NF-kB Médie le dysfonctionnement induit par Aß dans les mitochondries
La maladie D’Alzheimer (MA) est associée à l’accumulation de plaques Aß et/ou à l’apparition d’enchevêtrements neurofibrillaires (NFT) dans certaines régions du cerveau (Duyckaerts et al., 2009)., Cependant, une controverse existe quant à savoir si Aß est un agent causal de la MA ou si Aß est simplement corrélé avec le vieillissement. Accumuler des preuves (Aliev et al., 2009; Correia et coll., 2012; Cadonic et coll., 2016; Cardoso et coll., 2017; Djordjevic et coll., 2017) souligne également maintenant les changements dans le métabolisme cérébral entraînés par le dysfonctionnement mitochondrial en tant que Processus central de nombreux troubles neurodégénératifs liés à l’âge, y compris la MA. En plus de ces preuves, il existe également des altérations de l’activité enzymatique des complexes protéiques de L’ETC et des altérations de l’activité enzymatique antioxydante (Kolosova et al.,, 2017) dans AD. En particulier, il a été démontré que L’activité du complexe IV était négativement affectée dans la MA (Mutisya et al., 1994).
Dans une étude récente par Shi et coll. (2014), il a été constaté que Aß altérait la fonction mitochondriale via la signalisation NF-kB. De plus, Shi et al. (2014) ont montré ici que Aß diminuait l’expression de la sous-unité de COX III via une voie NF-kB., Fait important, pour éliminer la possibilité que IkBa soit phosphorylée par Aß dans le cytoplasme (puis transportée dans les mitochondries), des mitochondries isolées ont été incubées avec Aß en présence (ou en absence) d’un bloqueur NF-kB, à savoir BAY11-7082. Ici, ils ont trouvé la phosphorylation induite par Aß et la dégradation D’IkBa dans des mitochondries isolées.
ces résultats ont également des implications importantes pour le traitement de la MA, comme l’ont démontré de récentes études de Snow et al. (2018) et comme le montrent d’autres études connexes (Djordjevic et al., 2017; Adlimoghaddam et coll.,, 2019) qui suggèrent de cibler la signalisation NF-kB dans les mitochondries peut avoir une valeur thérapeutique. Par exemple, dans Snow et al.l’étude, créatine-un modulateur connu de la fonction mitochondriale (Tarnopolsky et Beal, 2001), a été montré pour augmenter et modifier positivement les niveaux de protéines de CaMKII, PSD-95 et complexe 1 sous-unités chez les souris nourries à la créatine, tandis que la sous-unité IkB inhibitrice de NF-kB a été diminuée. Pour en savoir plus sur l’effet thérapeutique potentiel de la créatine sur la fonction mitochondriale et dans les troubles mitochondriaux ou d’autres troubles neurologiques, voir les études et les revues de Matthews et al., (1998), Klivenyi et coll. (1999), Tarnopolsky et Beal (2001), Hersch et coll. (2006), Rodriguez et coll. (2007) et Beal (2011).
rôle du NF-kB dans L’Inflammation et le métabolisme Mitochondrial
augmentation des données (Lamas et al., 2003; Mauro et coll., 2011; Moretti et coll., 2012) suggèrent que la signalisation NF-kB, qui est un médiateur des processus inflammatoires, fonctionne également comme régulateur et intégrateur du métabolisme énergétique. Dans une étude récente de Zhong et al. (2016), il a été démontré que le NF-kB limite l’activation des inflammasomes via l’élimination des mitochondries endommagées., Étonnamment, le NF-kB semblait à la fois amorcer l’inflammasome NLRP-3 pour l’activation et également prévenir une inflammation excessive et freiner l’activation de l’inflammasome NLRP-3; bien que le mécanisme de retenue soit mal défini. Ici, il a été spéculé qu’en plus de NF-kB étant un activateur de gènes inflammatoires, il a également fonctionné dans cette étude en limitant l’activation de L’inflammasome NLRP3 et la production d’IL-1β. De plus, il a été constaté que l’induction de p62 était responsable de l’activité inhibitrice de l’inflammasome par NF-kB., Il semble que NF-kB peut contenir sa propre inflammation dans les macrophages en favorisant l’élimination médiée par p62 des mitochondries endommagées (mitophagie) après que les macrophages interagissent avec différents activateurs de l’inflammasome NLRP3.
Conclusion
Il y a plus de 10 ans, le NF-kB a été détecté dans les mitochondries. Étonnamment, pour un facteur de transcription aussi important, peu de progrès ont été réalisés dans la découverte de rôles spécifiques pour NF-kB affectant la mitochondrie., Certaines études, telles que décrites ci-dessus, fournissent des preuves de la NF-kB dans la dynamique mitochondriale, l’apoptose, le contrôle respiratoire, l’expression des gènes et les mécanismes de la maladie (Figure 1). Cependant, la duplication de ces résultats et la validation globale sont encore nécessaires par d’autres laboratoires. Des informations supplémentaires peuvent être tirées du fait que d’autres facteurs de transcription ayant des effets sur les gènes nucléaires, tels que AP-1, p53, CREB, c-Myc, Wnt13, Dok-4, HMGA1 et c-Src ont également été détectés dans les mitochondries (Psarra et Sekeris, 2008)., Fait intéressant, des sites de liaison dans le génome mitochondrial (homologues à leurs sites de liaison dans l’ADN nucléaire) pour certains de ces facteurs ont été déterminés (Psarra et Sekeris, 2008) où des rôles pour la transcription mitochondriale et l’apoptose sont suspectés et montrent des modèles globaux d’activité. Par exemple, on peut faire valoir que certains de ces facteurs (NF-kB, CREB et AP-1) se lient aux génomes mitochondriaux et atténuent principalement l’expression des gènes mitochondriaux (Blumberg et al., 2014), tout en ayant des effets stimulateurs sur la transcription des gènes nucléaires., Cependant, il est clair que plus de travail est nécessaire non seulement pour trouver des rôles précis de l’activité, mais aussi pour déterminer si des modèles globaux d’activité existent vraiment.
Après avoir examiné cette littérature, il devient également évident que le rôle du NF-kB dans la régulation de la respiration mitochondriale a des implications profondes et démontre un niveau de complexité jamais apprécié auparavant. Par exemple, Mauro et coll. (2011) les données établissent un rôle pour NF-kB dans l’adaptation métabolique dans les cellules normales et dans le cancer, et suggèrent également des conséquences pour d’autres états pathologiques tels que la MA., En outre, étant donné que NF-kB peut contenir sa propre inflammation, comme le montrent Zhong et al. (2016), non seulement est surprenant, mais illustre en outre la complexité de la signalisation NF-kB dans la fonction mitochondriale.
dans cette revue, des études ont été étudiées sur le rôle du NF-kB dans la fonction mitochondriale, et il semble que la recherche dans ce domaine soit en augmentation. Compliquer les résultats est cependant l’observation que plusieurs facteurs jouent des rôles similaires dans la fonction mitochondriale et donc des études détaillées spécifiques à chaque facteur sont nécessaires., En conclusion, nous pouvons poser à nouveau la question-Que fait NF-kB Dans et vers la mitochondrie? La réponse immédiate et abrégée serait-beaucoup!
contributions de L’auteur
L’auteur a créé le sujet et écrit le manuscrit.
Financement
Ce travail a été financé par les Instituts de recherche en santé du Canada (IRSC), le Partenariat canadien pour l’Agriculture (PAC), la fondation de recherche de l’Hôpital Saint-Boniface, La Société Alzheimer du Manitoba, recherche Manitoba, L’honorable Douglas et Patricia Everett et le Fonds de dotation Royal Canadian Properties Limited.,
déclaration de conflit d’intérêts
l’auteur déclare que la recherche a été menée en l’absence de toute relation commerciale ou financière pouvant être interprétée comme un conflit d’intérêts potentiel.
Remerciements
L’auteur tient à remercier le Dr Grant Trappe pour une révision du manuscrit.
Hayden, M. S., et Ghosh, S. (2004). Signalisation à NF-kappaB. Les Gènes Dev. 18, 2195–2224.
PubMed Abstract / Google Scholar
Wang, X. Et Chen, X. J. (2015)., Un réseau cytosolique supprimant le stress protéostatique médié par les mitochondries et la mort cellulaire. La Nature 524, 481-484. doi: 10.1038/nature14859
PubMed Abstract | CrossRef Texte Intégral | Google Scholar