objectifs D’apprentissage
- définir la corrosion
- énumérer quelques-unes des méthodes utilisées pour prévenir ou ralentir la corrosion
La Corrosion est généralement définie comme la dégradation des métaux due processus électrochimique. La formation de rouille sur le fer, le ternissement sur l’argent et la patine bleu-vert qui se développe sur le cuivre sont tous des exemples de corrosion., Le coût total de la corrosion aux États-Unis est important, avec des estimations dépassant un demi-billion de dollars par an.
L’exemple le plus connu de corrosion est peut-être la formation de rouille sur le fer. Le fer rouille lorsqu’il est exposé à l’oxygène et de l’eau. Les principales étapes de la rouille du fer semblent impliquer ce qui suit (Figure 2). Une fois exposé à l’atmosphère, le fer s’oxyde rapidement.
Les électrons réduisent l’oxygène dans l’air dans les solutions acides.
Ce que nous appelons la rouille est hydratés de fer(III) oxyde d’azote, qui se forme lorsque le fer(II) des ions réagissent plus avec de l’oxygène.,
Le nombre de molécules d’eau est variable, il est donc représenté par X. contrairement à la patine sur le cuivre, la formation de rouille ne crée pas de couche protectrice et la corrosion du fer continue alors que la rouille s’écaille et expose le fer frais à l’atmosphère.
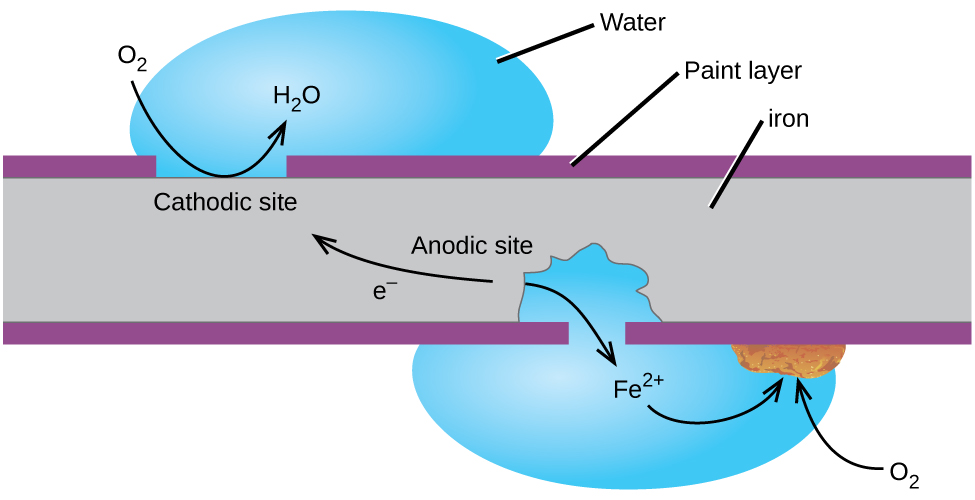
Une façon de garder le fer de la corrosion est de le garder peint. La couche de peinture empêche l’eau et l’oxygène nécessaires à la formation de rouille d’entrer en contact avec le fer. Tant que la peinture reste intacte, le fer est protégé de la corrosion.,
d’Autres stratégies comprennent l’alliage de fer avec d’autres métaux. Par exemple, l’acier inoxydable est principalement du fer avec un peu de chrome. Le chrome a tendance à s’accumuler près de la surface, où il forme une couche d’oxyde qui protège le fer.
Le fer zingué ou galvanisé utilise une stratégie différente. Le Zinc est plus facilement oxydé que le fer car le zinc a un potentiel de réduction plus faible. Puisque le zinc a un potentiel de réduction plus faible, c’est un métal plus actif. Ainsi, même si le revêtement de zinc est rayé, le zinc s’oxydera toujours avant le fer., Cela suggère que cette approche devrait fonctionner avec d’autres métaux actifs.
un autre moyen important de protéger le métal est d’en faire la cathode dans une cellule galvanique. Il s’agit d’une protection cathodique et peut être utilisé pour des métaux autres que le fer. Par exemple, la rouille des réservoirs de stockage et des tuyaux souterrains de fer peut être évitée ou considérablement réduite en les connectant à un métal plus actif tel que le zinc ou le magnésium (Figure 3). Il est également utilisé pour protéger les pièces métalliques dans les chauffe-eau., Les métaux les plus actifs (potentiel de réduction plus faible) sont appelés anodes sacrificielles parce qu’ils s’épuisent car ils se corrodent (s’oxydent) à l’anode. Le métal protégé Sert de cathode et ne s’oxyde donc pas (corrode). Lorsque les anodes sont correctement surveillées et remplacées périodiquement, la durée de vie utile du réservoir de stockage de fer peut être considérablement prolongée.
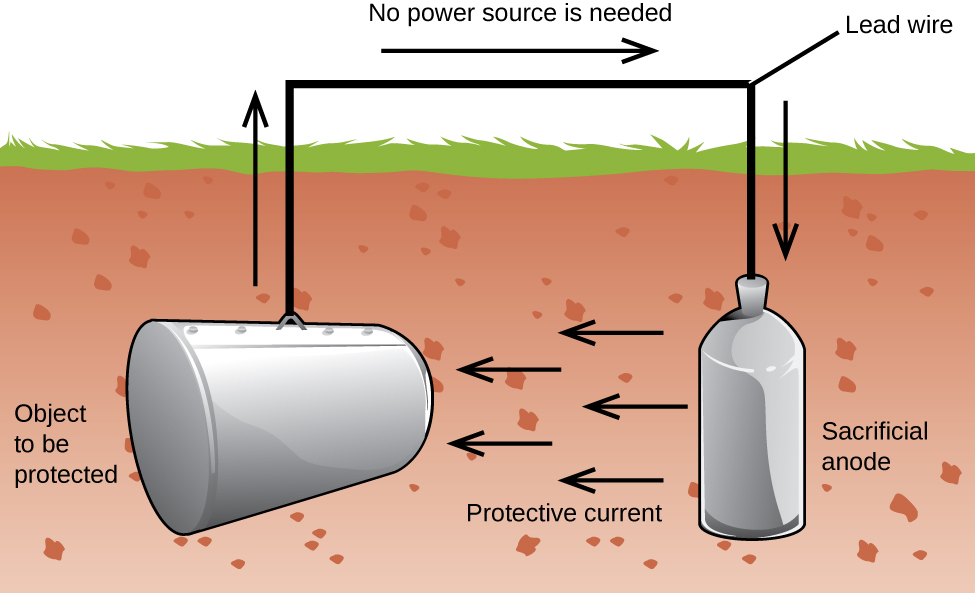
à la Corrosion est la dégradation d’un métal causé par un processus électrochimique. D’importantes sommes d’argent sont dépensées chaque année pour réparer ou prévenir les effets de la corrosion. Certains métaux, tels que l’aluminium et le cuivre, produisent une couche protectrice lorsqu’ils se corrodent dans l’air., La couche mince qui se forme à la surface du métal empêche l’oxygène d’entrer en contact avec plus d’atomes de métal et « protège” ainsi le métal restant d’une corrosion supplémentaire. Le fer se corrode (forme de la rouille) lorsqu’il est exposé à l’eau et à l’oxygène. La rouille qui se forme sur le métal de fer s’écaille, exposant le métal frais, qui se corrode également. Une façon de prévenir ou de ralentir la corrosion consiste à enduire le métal. Le revêtement empêche l’eau et l’oxygène d’entrer en contact avec le métal. La peinture ou d’autres revêtements ralentiront la corrosion, mais ils ne sont pas efficaces une fois rayés., Le fer zingué ou galvanisé exploite le fait que le zinc est plus susceptible de s’oxyder que le fer. Tant que le revêtement reste, même s’il est rayé, le zinc s’oxydera avant le fer. Une autre méthode de protection des métaux est la protection cathodique. Dans ce procédé, un métal facilement oxydé et peu coûteux, souvent du zinc ou du magnésium (l’anode sacrificielle), est connecté électriquement au métal qui doit être protégé. Le plus actif en métal est l’anode sacrificielle, et est l’anode dans une cellule galvanique. Le métal « protégé » est la cathode, et reste non oxydé., Un avantage de la protection cathodique est que l’anode sacrificielle peut être surveillée et remplacée si nécessaire.,
Glossaire
procédé de protection cathodique pour protéger le métal en utilisant une anode sacrificielle et en rendant efficacement le métal qui doit protéger la cathode, empêchant ainsi son oxydation corrosion dégradation du métal par un procédé électrochimique procédé de fer galvanisé pour protéger le fer en le recouvrant de zinc, qui s’oxydera avant le fer; anode sacrificielle en fer zingué métal chapitre exercices
2., Mg et Zn
4. Les deux exemples impliquent une protection cathodique. L’anode (sacrificielle) est le métal qui se corrode (s’oxyde ou réagit). Dans le cas du fer (-0,447 V) et du zinc (-0,7618 V), le zinc a un potentiel de réduction standard plus négatif et sert donc d’anode. Dans le cas du fer et du cuivre (0,34 V), le fer a le plus petit potentiel de réduction standard et se corrode donc (sert d’anode).
6., Bien que le potentiel de réduction du lithium le rendrait capable de protéger les autres métaux, ce potentiel élevé indique également à quel point le lithium est réactif; il aurait une réaction spontanée avec la plupart des substances. Cela signifie que le lithium réagirait rapidement avec d’autres substances, même celles qui n’oxyderaient pas le métal qu’il tente de protéger. Une réactivité comme celle-ci signifie que l’anode sacrificielle serait épuisée rapidement et devrait être remplacée fréquemment. (Raison supplémentaire facultative: risque d’incendie en présence d’eau.)