la théorie Brønsted-Lowry des acides et des Bases
la théorie Brønsted-Lowry des acides et des bases a poussé la définition D’Arrhenius un peu plus loin, car une substance n’a plus besoin d’être composée d’ions hydrogène (H+) ou hydroxyde (OH-) pour être classée comme acide ou base. Pour exmapl, considérons l’équation chimique suivante:
\
- Un acide de Brønsted-Lowry est un donneur de protons (ions hydrogène).
- Une base de Brønsted-Lowry est un accepteur de protons (ions hydrogène).,
Dans cette théorie, un acide est une substance qui peut libérer un proton (comme dans la théorie d’Arrhenius) et une base est une substance qui peut accepter un proton., Un sel basique, tel que Na+F-, génère des ions OH – dans l’eau en prenant des protons de l’eau elle-même (pour faire de L’HF):
\
- dissociation acide
\
- constante D’ionisation acide:
\}{}\]
- dissociation de Base:
\
- constante d’ionisation des bases
\}{}\]
la détermination d’une substance en tant qu’acide ou base de Brønsted-Lowery ne peut se faire qu’en observant la réaction. Dans le cas de la HOH c’est une base dans le premier cas et d’un acide, dans le second cas.,
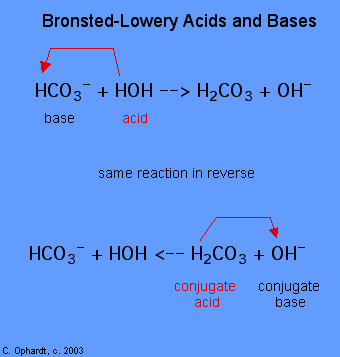
pour déterminer si une substance est un acide ou une base, comptez les hydrogènes sur chaque substance avant et après la réaction. Si le nombre d’hydrogènes a diminué, cette substance est l’acide (donne des ions hydrogène). Si le nombre d’hydrogènes a augmenté, cette substance est la base (accepte les ions hydrogène). Ces définitions sont normalement appliquées aux réactifs à gauche. Si la réaction est vue en sens inverse, un nouvel acide et une nouvelle base peuvent être identifiés., Les substances du côté droit de l’équation sont appelées acide conjugué et base conjuguée par rapport à celles de gauche. Notez également que l’acide d’origine tourne dans la base conjuguée après la fin de la réaction.
Remarque
Les acides sont des donneurs de protons et les Bases sont des accepteurs de protons
Pour qu’une réaction soit en équilibre, un transfert d’électrons doit se produire. L’acide donnera un électron et la base recevra l’électron. Les acides et les Bases qui travaillent ensemble de cette manière sont appelés une paire conjuguée composée d’acides conjugués et de bases conjuguées.,
\
A représente un composé Acide et Z représente un composé de Base
- Un Don de H pour former HZ+.
- Z accepte H de A qui forme HZ +
- A-devient base conjuguée de HA et dans la réaction inverse, il accepte un H de HZ pour recréer HA afin de rester en équilibre
- HZ + devient un acide conjugué de Z et dans la réaction inverse, il donne un H à A-recréer Z afin de rester en équilibre