le modèle de Bohr de 1913 de l’atome d’hydrogène a été remplacé par le modèle mécanique d’onde Schrodingerʹs en 1926. Cependant, le modèle de Bohrss est encore enseigné de manière rentable aujourd’hui en raison de sa simplicité conceptuelle et mathématique, et parce qu’il a introduit un certain nombre d’idées clés en mécanique quantique telles que le nombre quantique, la quantification des propriétés observables, le saut quantique et l’état stationnaire.,
Bohr a calculé la variété des énergies d’électrons autorisées en équilibrant les forces mécaniques (centripète et électron‐noyau) sur un électron exécutant une orbite circulaire de rayon R autour du noyau, puis en quantifiant arbitrairement son moment angulaire. Enfin, par fiat, il a déclaré que l’électron était dans un état stationnaire non rayonnant parce qu’une charge en orbite (accélération) rayonne de l’énergie et s’effondrera dans le noyau de charge opposée.,
en 1924, de Broglie postule la dualité onde‐particule pour l’électron et d’autres particules massives, offrant ainsi l’occasion de supprimer une partie de l’arbitrage du modèle de Bohrss. Par exemple, un électron possédant des propriétés ondulatoires est soumis à des interférences constructives et destructrices. Comme on le montrera, cela conduit naturellement à la quantification de l’impulsion électronique et de l’énergie cinétique, et par conséquent à une multitude d’États d’énergie autorisés pour l’électron par rapport au noyau., Le modèle de de Broglie-Bohr de l’atome d’hydrogène présenté ici traite l’électron comme une particule sur un anneau ayant des propriétés ondulatoires.
\
l’hypothèse de de Broglie que la matière a des propriétés ondulatoires.
\
la conséquence de l’hypothèse de de Broglieʹs; un nombre intégral de longueurs d’onde doit tenir dans la circonférence de l’orbite. Ceci introduit le nombre quantique qui peut avoir des valeurs 1,2,3,… L’État n = 4 électron est illustré ci-dessous.,
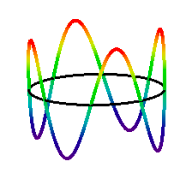
\
la Substitution de la première équation dans la seconde équation révèle que l’élan est quantifié.
\
Si l’impulsion est quantifiée, l’énergie cinétique l’est aussi.
\
ce qui signifie que l’énergie totale est quantifiée. Le deuxième terme est l’énergie potentielle électrostatique électron‐proton.
l’interprétation mécanique quantique de ces orbites ʺBohr is est qu’elles sont des États stationnaires. Malgré le fait que nous utilisions l’expression énergie cinétique, qui implique le mouvement des électrons, Il n’y a pas de mouvement., L’électron occupe l’orbite comme une onde particulaire, il n’est pas en orbite autour du noyau. S’il orbitait dans un sens classique, il rayonnerait de l’énergie et s’effondrerait rapidement dans le noyau. De toute évidence, la stabilité de la matière nécessite la version mécanique quantique de l’énergie cinétique.
L’état fondamental de l’énergie et de l’orbite de rayon de l’électron dans l’atome d’hydrogène est trouvé en traçant l’énergie en fonction du rayon orbital. L’état fondamental est le minimum dans la courbe d’énergie totale., Naturellement, le calcul peut être utilisé pour obtenir les mêmes informations en minimisant l’énergie par rapport au rayon de l’orbite. Cependant, la méthode graphique a le mérite d’éclairer la question de la stabilité atomique.
constantes fondamentales: charge électronique, masse électronique, constante de Planck, permitivité du vide.
nombre quantique et fait de conversion entre mètres et picomètres et joules et attojoules.
\
\
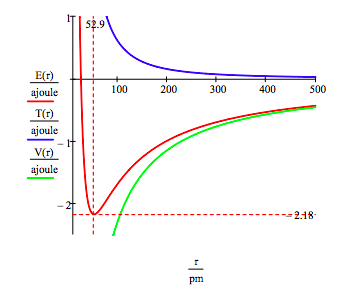
Cette figure montre que la stabilité atomique implique un équilibre entre l’énergie potentielle et cinétique., L’électron est attiré vers le noyau par l’interaction d’énergie potentielle attractive (~-1/R), mais est empêché de s’effondrer dans le noyau par l’énergie cinétique extrêmement importante (~1/R2) associée aux petites orbites.
comme indiqué ci-dessous, l’approche graphique peut également être utilisée pour trouver les états excités électroniques.
\
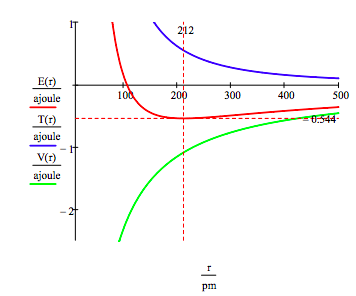
comme mentionné précédemment, la variété des énergies d’électrons autorisées peut également être obtenue en minimisant l’énergie par rapport au rayon de l’orbite. Cette procédure donne,