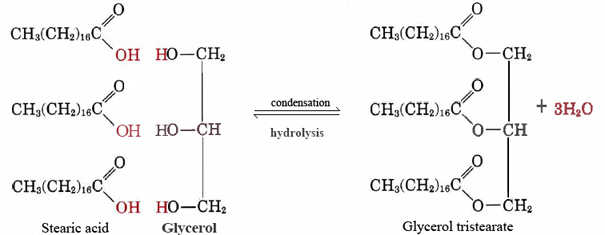
un bon exemple de lipide non polaire est le tristéarate de glycérol gras neutre. Cette forme la plus courante de graisse animale sert d’entrepôt d’énergie et d’isolation contre les pertes de chaleur. Au niveau moléculaire, il est construit à partir de trois molécules d’acide stéarique et d’une de glycérol:
 (1)
(1)
un grand nombre de lipides non polaires peuvent être fabriqués en combinant différents acides à longue chaîne avec du glycérol., Parce que ces acides étaient à l’origine dérivés de graisses, ils sont collectivement appelés acides gras.
notez que pour chaque molécule d’acide stéarique ou autre acide gras qui se combine avec l’un des groupes-OH du glycérol, une molécule d’eau est émise, et la réaction est donc une condensation. Il s’avère qu’un grand nombre de molécules biologiques importantes sont assemblées par des réactions de condensation au cours desquelles de l’eau est émise. À l’inverse de l’Eq. (1), dans lequel l’eau réagit avec une grosse molécule et la divise en morceaux plus petits, est appelée hydrolyse., En effectuant une hydrolyse, les organismes vivants peuvent décomposer les molécules fabriquées par d’autres espèces. Les blocs de construction simples obtenus de cette manière peuvent ensuite être recombinés par des réactions de condensation pour former des structures appropriées à leur nouvel hôte.
contrairement au tristéarate de glycérol trouvé chez les animaux, les graisses végétales contiennent de nombreuses doubles liaisons dans leurs longues chaînes hydrocarbonées. Cette polyinsaturation introduit des « plis » dans les chaînes hydrocarbonées en raison de la barrière à la rotation et des angles de 120° associés aux doubles liaisons., Par conséquent, il est plus difficile d’aligner les chaînes côte à côte (voir Figure \(\PageIndex{1}\)), et les graisses insaturées ne s’emballent pas aussi facilement dans un réseau cristallin. Comme c’était vrai avec les alcanes, la longueur de la chaîne détermine également si une graisse est liquide ou solide, et où le point de fusion se produit.
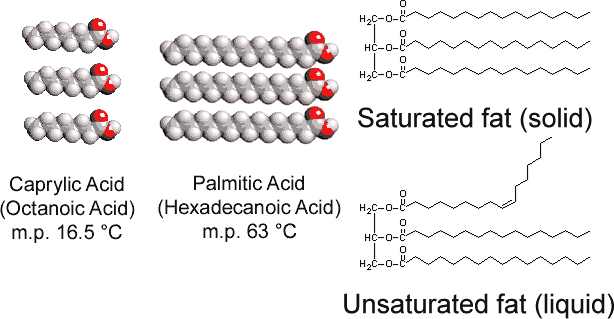
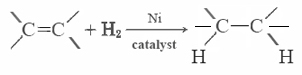
La plupart des graisses insaturées (comme l’huile de maïs) sont liquides à des températures ordinaires, tandis que les graisses saturées (comme le beurre) sont solides. Les huiles végétales peuvent être converties par hydrogénation en composés solides. Ce procédé consiste à ajouter du H2 catalytiquement aux doubles liaisons:
L’hydrolyse des graisses est importante dans la fabrication des savons., Il peut être accéléré par l’ajout d’une base forte comme NaOH ou KOH, auquel cas la réaction est appelée saponification. Puisque la saponification exige que le pH du mélange réactionnel soit élevé, l’acide gras qui est produit se dissociera en son anion. Lorsque le tristéarate de glycérol est saponifié avec du NaOH, par exemple, il se forme du stéarate de sodium, une substance relativement soluble dans l’eau et un savon courant.
la capacité des savons à nettoyer la graisse et l’huile des surfaces souillées est le résultat de la double structure hydrophobe-hydrophile de leurs molécules., L’ion stéarate, par exemple, consiste en une longue chaîne hydrocarbonée non polaire avec un groupe COO hautement polaire à une extrémité.
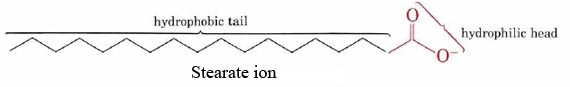
la chaîne hydrocarbonée hydrophobe essaie d’éviter le contact avec les milieux aqueux, tandis que le groupe anionique accueille facilement les attractions dipolaires et les liaisons hydrogène des molécules d’eau.
Les deux principales façons dont les parties hydrophobes des ions stéarate peuvent éviter l’eau sont de se regrouper à la surface ou de se dissoudre dans une petite quantité d’huile ou de graisse (voir Figure \(\PageIndex{2}\) ).,
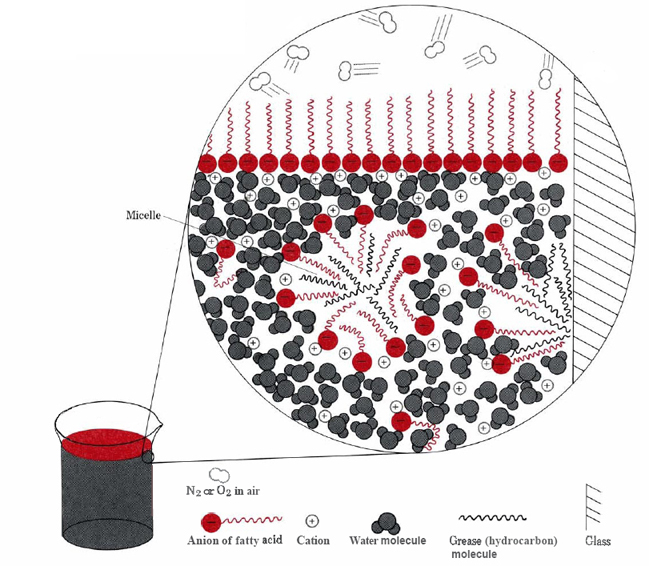
dans ce dernier cas, les têtes hydrophiles des molécules de savon entrent en contact avec l’eau à l’extérieur de la graisse, formant une structure appelée micelle. Étant donné que les extérieurs des micelles sont chargés négativement, ils se repoussent les uns les autres et empêchent les gouttelettes de graisse de se recombiner., La graisse est donc en suspension (émulsionnée) dans l’eau et peut être facilement lavée.
Les savons naturels, tels que le stéarate de sodium, étaient à l’origine fabriqués à la maison en chauffant de la graisse animale avec des cendres de bois, qui contenaient de la potasse, K2CO3. De grandes quantités sont encore produites industriellement, mais dans une large mesure, les savons ont été remplacés par des détergents. Ceci est une conséquence du comportement indésirable des savons dans l’eau dure. Le Calcium, le magnésium et d’autres cations d’eau dure forment des composés insolubles lorsqu’ils sont combinés avec les anions des acides gras., Cela produit des précipités scummy et empêche les molécules de savon d’émulsionner la graisse à moins qu’un excès important ne soit utilisé.
Les détergents tels que les alkylbenzènesulfonates (ABS) et les alkylbenzènesulfonates linéaires (LAS) ont des structures très similaires au stéarate de sodium, sauf que le groupe chargé dans leurs têtes hydrophiles est —SO3– attaché à un cycle benzénique. Les détergents ABS ont également des groupes méthyle (CH3) se ramifiant de leurs chaînes hydrocarbonées.,
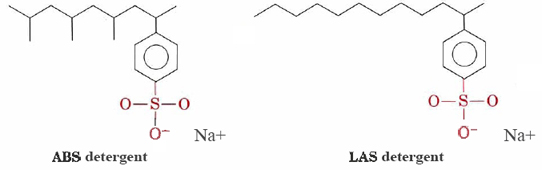
de telles molécules ne précipitent pas avec des cations d’eau dure et conviennent donc mieux au lavage en machine des vêtements. Les détergents LAS ont remplacé L’ABS au milieu des années 1960 lorsqu’il a été découvert que ces derniers n’étaient pas biodégradables. Ils faisaient que les rivières et même l’eau du robinet se couvraient de mousse et de mousse détergente. Apparemment, les enzymes des micro-organismes qui avaient évolué pour décomposer les chaînes d’hydrocarbures non ramifiées dans les graisses naturelles et les acides gras étaient incapables de digérer les chaînes ramifiées des molécules D’ABS., Les détergents LAS, bien que fabriqués par des humains, imitent les structures des molécules naturelles et sont biodégradables.