Introduction
Les électrons n’ont pas de position fixe dans les atomes, les composés et les molécules (voir image ci-dessous) mais ont des probabilités d’être trouvés dans certains espaces (orbitales). Les formes de résonance illustrent les zones de probabilités plus élevées (densités d’électrons). C’est comme tenir votre chapeau dans votre main droite ou votre gauche. Le terme résonance est appliqué lorsqu’il y a deux possibilités ou plus disponibles., Les chimistes utilisent des diagrammes de Lewis pour représenter la structure et la liaison des entités covalentes, telles que les molécules et les ions polyatomiques, désormais, les molécules. Le diagramme de Lewis de la molécule, cependant, n’est pas compatible avec les propriétés observées de la molécule.
exemple \(\PageIndex{1}\): Ion Nitrate
l’ion nitrate, selon son diagramme de Lewis, a deux types de liaisons azote-oxygène, une double liaison et deux liaisons simples, suggérant qu’une liaison azote-oxygène dans l’ion nitrate est plus courte et plus forte que chacune des deux autres., En outre, la structure de Lewis implique, en ce qui concerne la charge formelle, qu’il existe deux types d’atomes d’oxygène dans l’ion nitrate, l’un formellement neutre et chacun des deux autres portant une charge formelle de -1. Expérimentalement, cependant, les trois liaisons azote-oxygène dans l’ion nitrate ont la même longueur de liaison et la même énergie de liaison, et les trois atomes d’oxygène sont indiscernables. Le diagramme de Lewis ne permet pas d’expliquer de manière satisfaisante la structure et la liaison de l’ion nitrate.
deux diagrammes de Lewis supplémentaires peuvent être dessinés pour l’ion nitrate.,
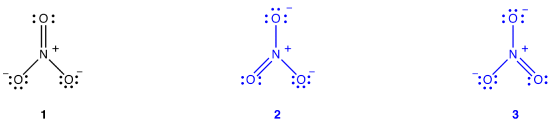
Cependant, aucun d’entre eux sont compatibles avec les propriétés observées de l’ion nitrate et, par conséquent, ne permet pas de représenter correctement l’ion nitrate.
exemple \(\PageIndex{2}\): benzène
le benzène, selon son diagramme de Lewis, a deux types de liaisons carbone-carbone, trois doubles liaisons et trois liaisons simples, suggérant que chacune des trois liaisons carbone-carbone dans le benzène est plus courte et plus forte que chacune des trois autres. Expérimentalement, cependant, les six liaisons carbone-carbone dans le benzène ont la même longueur de liaison et la même énergie de liaison., Le diagramme de Lewis ne permet pas d’expliquer de manière satisfaisante la structure et la liaison du benzène.
un attribut des molécules dont le diagramme de Lewis classique n’est pas compatible avec les propriétés observées est que d’autres diagrammes de Lewis valides peuvent être générés pour eux. Un diagramme de Lewis supplémentaire peut être dessiné pour le benzène.

cependant, aucun d’entre eux ne correspond aux propriétés observées du benzène et, par conséquent, ne représente pas correctement le benzène.,
La théorie de la résonance est une tentative d’expliquer la structure d’une espèce, comme l’ion nitrate ou le benzène, dont aucun diagramme de Lewis n’est compatible avec les propriétés observées de l’espèce. Le principal avantage de la théorie de la résonance est que, bien que basée sur une analyse mathématique rigoureuse, la théorie de la résonance peut être appliquée avec succès en invoquant peu ou pas de mathématiques. La théorie de la résonance est expliquée ci-dessous en utilisant l’ion nitrate comme exemple.
selon la théorie de la résonance, la structure de l’ion nitrate n’est pas 1 Ni 2 Ni 3 mais la moyenne des trois, pondérée par la stabilité., Les diagrammes de Lewis 1, 2 et 3 sont appelés formes de résonance, structures de résonance ou contributeurs de résonance de l’ion nitrate. On dit que la structure de l’ion nitrate est un hybride de résonance ou, simplement, hybride des formes de résonance 1, 2 et 3. Chaque fois qu’il est nécessaire de montrer la structure de l’ion nitrate, les formes de résonance 1, 2 et 3 sont dessinées, reliées par des flèches à double tête.,
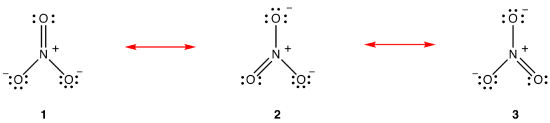
Les trois formes de résonance de l’ion nitrate, 1, 2, et 3, sont identiques, de sorte qu’ils ont la même stabilité et, par conséquent, contribuent également à l’hybride., Étant donné que la mesure exacte dans laquelle chaque forme de résonance de l’ion nitrate contribue à l’hybride est connue, l’ordre de liaison de chaque liaison azote-oxygène ainsi que la charge formelle sur chaque atome d’oxygène dans l’hybride peuvent être facilement déterminés:
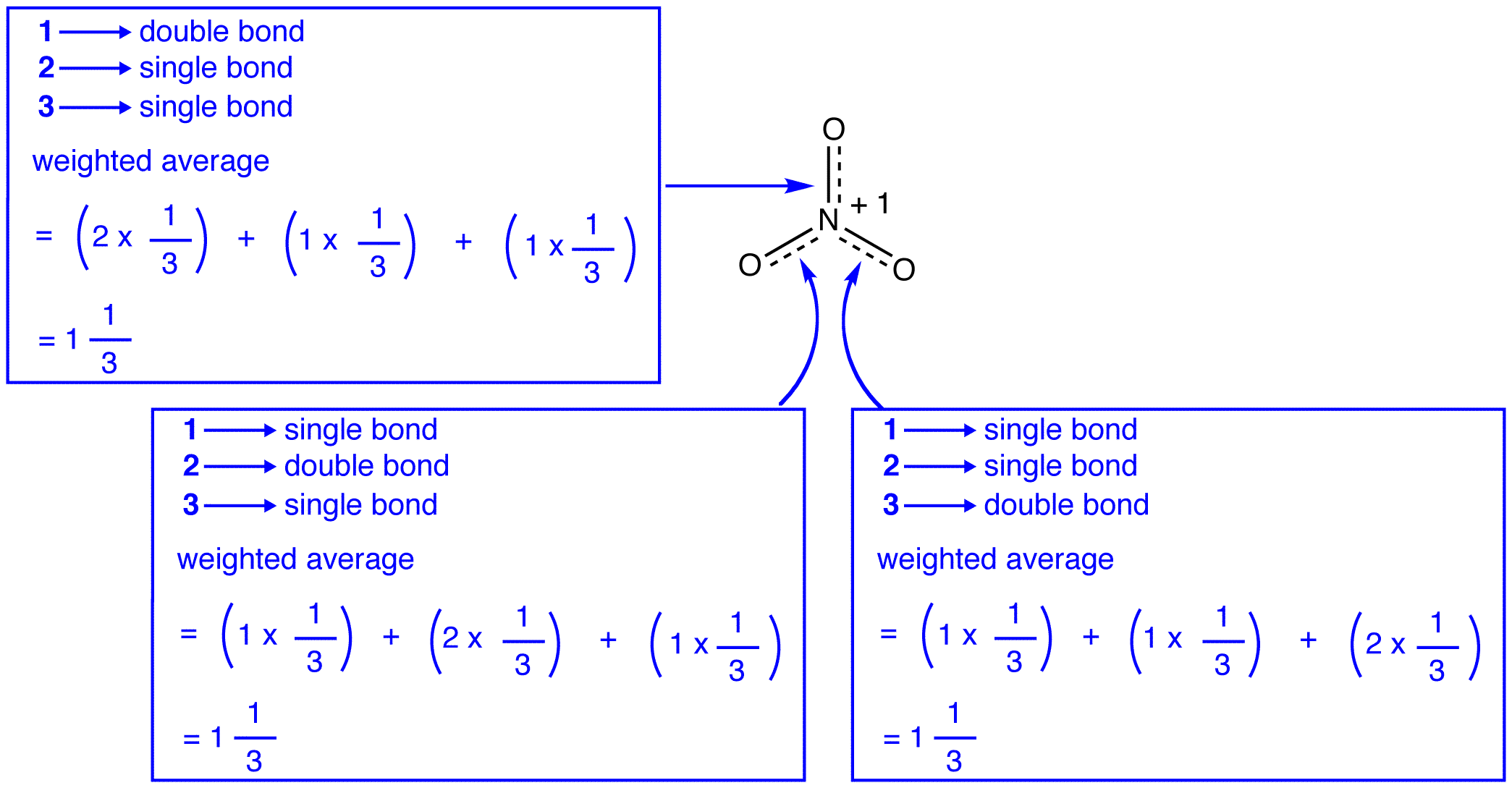
selon la théorie de la résonance, chaque liaison dans l’ion nitrate est un et un tiers même énergie de liaison.,
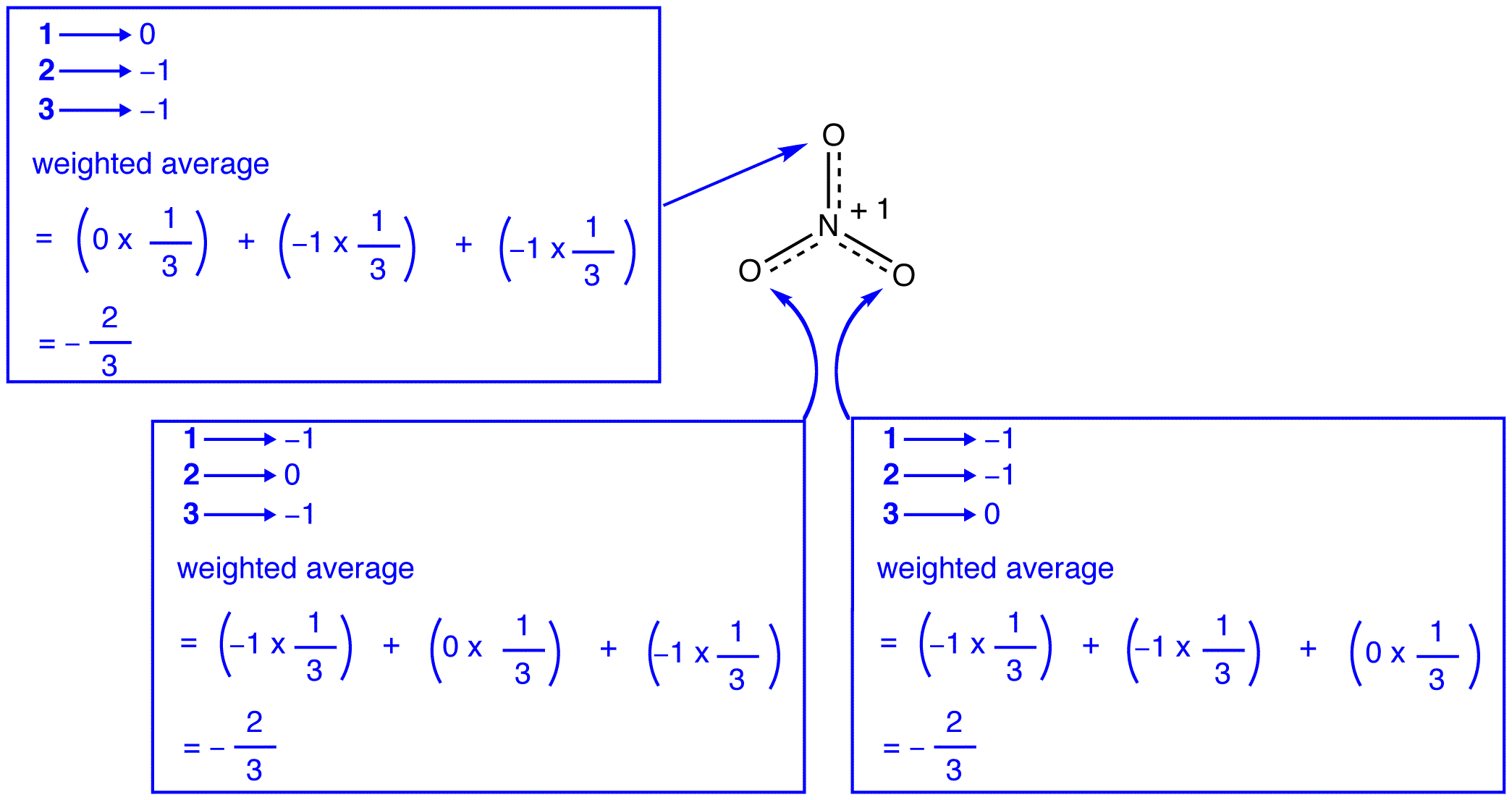
Selon la théorie de la résonance, chaque atome d’oxygène de l’ion nitrate est une accusation formelle de -2/3, qui, en conjonction avec le fait que les trois azote-oxygène obligations sont identiques, est cohérent avec l’observation que les trois atomes d’oxygène de l’ion nitrate sont indiscernables. Dans chaque forme de résonance de l’ion nitrate, il y a deux électrons \(\pi\), et ils ne sont partagés que par deux atomes. Un électron partagé uniquement par deux atomes est dit localisé., Ainsi, les deux électrons \(\pi\) dans chaque forme de résonance de l’ion nitrate sont localisés. L’ion nitrate, comme représenté par l’hybride, a deux \(\pi\) électrons:
- # électrons dans un \(\pi\) lien = 2
- # électrons dans un tiers de \(\pi\) lien = 2/3
- # électrons dans trois d’entre eux = 3 x (2/3) = 2
Les deux \(\pi\) des électrons de l’ion nitrate sont partagées par un total de quatre atomes, un atome d’azote et trois atomes d’oxygène. Un électron partagé par Plus de deux atomes serait délocalisé. Ainsi, les deux électrons \(\pi\) de l’ion nitrate sont délocalisés., La délocalisation des électrons \(\pi\) dans l’ion nitrate nécessite que les quatre atomes soient sur le même plan, ce qui permet un chevauchement latéral des orbitales p sur eux.,

Si l’énergie de l’ion nitrate ont été à la moyenne pondérée des énergies de ses trois résonance des formes, tout comme la structure de l’ion nitrate est la moyenne pondérée de la structure de ses trois formes de résonance, elle doit être égale à l’énergie de l’un des trois identiques résonance formes:

Si l’énergie de l’hybride ont été égale à celle d’une résonance de forme, étant donné que toutes les entités chimiques (les particules élémentaires, les atomes, les molécules, etc.,) naturellement ont tendance à être dans l’état d’énergie le plus bas possible, il n’y aurait aucun avantage pour l’ion nitrate d’exister en tant qu’hybride; il pourrait simplement exister en tant que forme de résonance. Puisque l’ion nitrate existe en tant qu’hybride, et non en tant que forme de résonance, on peut en déduire que l’énergie de l’hybride est inférieure à celle de l’une quelconque des formes de résonance.

Selon la théorie de la résonance ensuite, l’énergie d’une molécule est inférieur à celui de la plus basse énergie de résonance de forme., Depuis l’ion nitrate a moins d’énergie et, par conséquent, est plus stable que l’une de ses formes de résonance, l’ion nitrate est dit être stabilisé par résonance.
idées fausses courantes
Il existe deux idées fausses sur la théorie de la résonance chez les étudiants débutants, probablement en raison de l’interprétation littérale du mot résonance. Ils sont décrits ci-dessous, en utilisant l’ion nitrate comme exemple.
idée fausse 1: l’ion nitrate existe sous la forme de résonance 1 pendant un moment, puis change soit en forme de résonance 2, soit en forme de résonance 3, qui s’interconverse, ou revient à 1.,

La structure de l’ion nitrate est pas 1, ni 2, ni 3, mais l’hybride et ne change pas avec le temps, à moins de subir une réaction.
idée fausse 2: Dans un échantillon d’ions nitrate, à un moment donné, un tiers des ions existent sous la forme de résonance 1, un autre tiers sous la forme de résonance 2 et le tiers restant sous la forme de résonance 3.

Dans un échantillon d’ions nitrate, à un moment donné, tous les ions ont la même structure, ce qui est l’hybride.,
Mules et rhinocéros
l’analogie classique utilisée pour clarifier ces deux idées fausses est la mule (Morrison, R. T.; Boyd, R. N. Organic Chemistry, fifth edition; Allyn and Bacon: Boston, 1987, pg. 373). Biologiquement, une mule est un hybride d’un cheval et d’un âne. Cela ne signifie pas qu’une mule ressemble un instant à un cheval puis change pour ressembler à un âne. L’apparition d’une mule est une combinaison de celui d’un cheval et d’un âne et ne change pas avec le temps. Cela ne signifie pas non plus que, dans un troupeau, certaines mules ressemblent à un cheval et les autres à un âne., Dans un troupeau, tous les mulets ont la même apparence, qui est une combinaison d’un cheval et d’un âne. La faiblesse de cette analogie est que les chevaux et les ânes existent, alors que les formes de résonance sont strictement hypothétiques. Une meilleure analogie, citée dans Morrison et Boyd, est le rhinocéros. À la vue d’un rhinocéros, on pourrait le décrire comme l’hybride d’un dragon et d’une licorne, deux créatures qui n’existent pas.