Johdanto
Nuclear factor kappa B (NF-kB) on ikivanha proteiini transkriptio tekijä (Salminen et al., 2008) ja pidetään synnynnäisen immuniteetin säätelijänä (Baltimore, 2009). NF-kB signalointi reitin linkkejä patogeenisten signaaleja ja solujen vaaran merkkejä siten järjestää solujen vastustuskykyä hyökkääviä taudinaiheuttajia., Itse asiassa lukuisat tutkimukset ovat osoittaneet, NF-kB on verkon solmukohta vastuussa monimutkainen biologinen signalointi (Albensi ja Mattson, 2000; Kaltschmidt ja Kaltschmidt, 2009; Karin, 2009). Tätä varten NF-kB on arveltu olevan master-säädin evolutiivisesti konservoituneita biokemiallisia cascades (Mattson et al., 2000). Muut tekijät ovat myös kulkeutua mitokondrioita ja ovat mukana moduloiva ilmaus (Barshad et al., 2018a), mutta eivät ole tämän tarkastelun kohteena., Tämän tarkastelun tarkoituksena on yrittää ymmärtää, miten NF-kB: n aktiivisuus edistää mitokondrioiden toimintaa. Oletetaan, että lukijalla on jo käsitys mitokondrioiden perusbiologiasta. Tapauksessa lisätutkimuksia, lukija on tarkoitettu monia erinomaisia tutkimuksia ja katsauksia mitokondrioiden rakenne ja toiminta (Hall, 1979; Fox, 1982; Roger ja Silberman, 2002; Henze ja Martin, 2003; Conradt, 2006; Ettema, 2016; Wang ja Youle, 2016; Barshad et al., 2018b).,
NF-kB Aktivaatiota
Nuclear factor kappa B-alayksiköstä, joka käsittää NF-kB monimutkainen, on ilmaistu sekä neuronien ja glia. NF-kB-kompleksi on inaktiivisessa tilassa sytoplasmassa (Ghosh et al., 1998; Aggarwal ym., 2004; Hayden and Ghosh, 2004), jossa NF-kB: n aktivointia on kuvattu hyvin (Li and Karin, 2000; Baud and Jacque, 2008; Israel, 2010). TNFa sitoutuu TNF-reseptoreihin, kun sitä stimuloivat molekyylit, kuten TNFa, tai muut solustressorit (Kuva 1)., Tämä sitova, kautta useita välivaiheita, johtaa vuorovaikutus IkB-kinaasin (IKK) monimutkainen, joka sitten johtaa fosforylaatioon IkB, ja myöhemmin tuloksia IkB ubiquitination ja hajoaminen. Kerran huonontunut, jäljellä NF-kB-dimeeri (esim. p65/p50 alayksikön) translocates tumaan, missä se sitoutuu DNA yksimielisyys järjestyksessä eri kohde-geenit. NF-kB-vasteen selektiivisyys perustuu useisiin tekijöihin (Sen ja Smale, 2010), kuten dimeerikoostumukseen, ajoitukseen ja solutyyppiin., NF-kB: n vaikutusta solujen selviytymiseen on myös monimutkainen ja voi olla neuroprotektiivisia tai tulehdusta, riippuen solutyypistä, kehitysvaihe, ja patologinen tila (Qin ym., 2007).
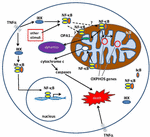
Kuva 1. Sytoplasmassa ja mitokondriossa olevien ydintekijän κ B (NF-kB) signalointireittien reitit. NF-kB-tri – subuntkompleksi (esim.p65, p50, IkB – yksi mahdollinen yhdistelmä) on sytoplasmassa inaktiivisessa tilassa. NF-kB-aktivaatio aloitetaan, kun molekyylit, kuten TNFa, sitoutuvat TNF-reseptoreihin (erilaisia on olemassa)., Myös muut ulkoiset tai sisäiset ärsykkeet voivat aktivoida NF-kB: tä. Monimutkainen signaali transduktio prosessi alkaa sitten, kun TNF-reseptorit aktivoituvat; IkB-kinaasin (IKK) on lopulta laukeaa ja johtaa fosforylaatioon IkB, joka johtaa IkB ubiquitination ja hajoaminen. Kun IkB on huonontunut, jäljellä NF-kB-dimeeri (esim. p65/p50 tai p50/p50-alayksikkö yhdistelmät ovat mahdollisia) translocates tumaan, missä se sitoutuu DNA yksimielisyys järjestyksessä tavoite geenit., Prosesseja ei tunneta hyvin, NF-kB monimutkainen tai NF-kB-alayksikön voi myös siirtyä mitochondrion, jossa todisteet viittaavat siihen, että se/ne vie intermembrane tilaa. Kun sisällä mitokondrioita, NF-kB on ajatellut vuorovaikutuksessa OXPHOS-geenien (mitokondrioiden mtDNA), joka johtaa ilmaus proteiineja mukana eri toimintoja, kuten mitokondrioiden dynamiikka ja COX III-asetuksen (osa Monimutkainen IV)., Näyttö myös vaikuttaisi osoittavan, NF-kB voi toimia kytkimenä mitokondrioita ja hallita tasapainon hyödyntäminen sytoplasman glykolyysin ja mitokondrioiden hengitystä normaaleissa soluissa ja syöpä. Lopuksi, tiedot osoittavat myös, että luontainen apoptoottisten polku stimulaatio, jossa NF-kB aktivaatiota mitokondrioissa johtaa sytokromi c: n vapautumista, mikä puolestaan johtaa caspase cascades ja ohjelmoitu solukuolema.,
Organisatorisesti, NF-kB on Suht perhe transkriptio tekijä ja liittyy viisi geenit, NF-kB1, NF-ks2, SUH, RELB, ja REL (Chen ja Greene, 2004); nämä geenit koodaavat useita proteiineja, NF-kB1, NF-ks2, Suh, RelB, ja c-Rel, vastaavasti, missä kaksi näistä proteiinit ovat suuri edeltäjä proteiineja tunnetaan p105 ja p100, että tehdään proteolyysi tulla p50 ja p52, vastaavasti. Nämä proteiinit sisältävät REL-homology verkkotunnukset (RHD) niiden amino-terminaalin alueella; RHD alue koostuu 2 erillistä, mutta viereisen verkkotunnuksia., Karboksi-terminaalialueelta kauimpana oleva sekvenssi mahdollistaa proteiinin sitoutumisen DNA: han. Enemmän sisustus-sekvenssin avulla Rel perheen proteiineja dimerize (homo – tai heterodimers) tukahduttaminen ilmaisun kautta sitovia ja niitä vastaavat perhe-estäjiä, IkB proteiineja (Chen ja Greene, 2004). Jälkimmäiseen sekvenssiin kuuluu ydinlokalisaatiosekvenssi (NLS), joka purkautuu, kun IKB: tä ei hajota. NLS: n tehtävänä on ohjata tai merkitä aktiivisia proteiineja solun tumaan tuontia varten (Chen and Greene, 2004; Karin et al., 2004; Barger ym.,, 2005).
nämä Kolme proteiineja (Suh, RelB, ja c-REL) myös koodata transactivation domain (Tacis) niiden karboksi-terminaalin alueella. Tacis-sallia, että nämä proteiinit vuorovaikutuksessa pohjapinta transkriptio laite, joka tunnetaan nimellä TATA sitova proteiini (TBP), Transkriptio Tekijä, IIB, sekä p300 ja cAMP response element (CREB) sitova proteiini (CBP) transkription co-aktivaattoreita (Chen ja Greene, 2004)., Vain nämä kolme proteiinit voivat aiheuttaa transkriptio DNA-koodaus alueilla, kun taas muut proteiineja, p50 ja p52 homodimers, voivat miehittää DNA: ta sitova sivustoja ilman aloittamisesta transkriptio. Tämän vuoksi P50: n ja p52: n myöhemmät 2 homodimeeriproteiinia toimivat transcriptionaalisina repressoreina (Chen ja Greene, 2004).
p105 ja p100 homodimers vievät DNA: ta sitova sivustoja siten estää transkription kautta transkriptio tekijät, jotka tehdä hallussaan TADs (haisu burgeri et al., 2005). Kolmas transcriptionaalisen sorron muoto johtuu IkB-proteiineista., Näitä proteiineja on useita ankyrin toistaa, koska niiden ydin toimialue ja toiminta sitovat RHD, että maski MAANMITTAUSLAITOKSEN (Karin et al., 2004). Ilman aktiivista NLS: ää NF-kB-proteiinit rajoittuvat sytoplasmaan eivätkä pysty siirtymään tumaan, joten transkriptio estyy.
NF-kB Löytyy Mitokondrioita
Vuonna 2001 tekemän tutkimuksen Bottero et al. (2001) havaitsivat, IkBa-ja NF-kB p65-alayksikkö vuonna subsellulaarisia fraktioita ja puhdistettu mitokondriot Jurkat-soluissa. Jurkat-solut ovat ikuistettu solulinja ihmisen t-lymfosyyttisoluista, joita käytetään leukemian tutkimiseen., Botteron tutkimuksessa selvisi, että IkBa ja NF-kB p65 sijaitsivat mitokondrion intermembraaniavaruudessa. Mitokondrio intermembrane space on tila, joka vallitsee sisäinen mitokondrioiden kalvo (IMM) ja ulompi mitokondrioiden kalvo (OMM).
myöhemmin Cogswell ym. (2003) osoitti myös, että mitokondrioista löytyi NF-kB-alayksiköitä, p50 ja p65 sekä IkBa. Tämän määrittämiseksi käytettiin useita menetelmiä todisteiden antamiseksi, mukaan lukien U937-solujen osien elektronimikroskopia., U937-solut eristettiin ensin keski-ikäisen miespotilaan lymfoomasta tutkimaan monosyyttien käyttäytymistä ja erilaistumista. Tässä Cogswell ym. (2003) pystyi visualisoimaan NF-kB P50: n ja p65: n alayksiköt ja IkBa: n mitokondrioiden sisäisessä matriisissa. Tässä tutkimuksessa tutkittiin myös rotan maksasoluja, ja myös p50-alayksiköt ja IkBa-alayksiköt tunnistettiin. Lisäksi U937 soluja stimuloitiin 1 h TNFa, tunnettu laukaista NF-kB signalointi reitin., Tässä kokeessa, Western blot-analyysit mitokondrioiden ja sytoplasman jakeet havaittu, että Tnf-hoidon aiheuttama menetys IkBa sekä mitokondrioiden ja soluliman osastoihin 30 min hoidon jälkeen viittaa siihen, että IkBa oli hajonnut. EMSA analyysin, in vitro-menetelmällä, joka tunnistaa NF-kB aktivaatiota ja epäspesifinen sitoutuminen DNA-sekvenssit, oli myös suoritettu proteiinia otettu ydinvoiman otteita mitokondriot eristetty U937 soluja stimuloidaan TNFa: aa., Täällä ne määritellään TNFa: n signalointi lisännyt DNA: ta sitovaa toimintaa NF-kB p50, proteiinia otettu mitokondrioita.
muissa tutkimuksissa mitokondrioissa on havaittu myös NF-kB: tä. Näitä ovat tutkimukset (Guseva ym., 2004; Zamora ym., 2004) ihmisen fibroblast HT1080-solulinjoissa, ihmisen eturauhasen lncap-ja PC3-solulinjoissa sekä HeLa-soluissa. LNCaP-soluissa mitokondrioiden NF-kB p50 ja p65 alayksiköiden todettiin sitoutuneen mitokondrioiden DNA: han (mtDNA)., Yhdessä nämä tutkimukset osoittavat todisteita NF-kB signalointi mitokondrioita ja että NF-kB säätelee mitokondrioiden mRNA ilmaisun (ks NF-kB ja mitokondrioiden geenien ilmentyminen-osiossa alla).
NF-kB Valvontaa Mitokondrioiden Dynamics
On olemassa useita proteiineja mukana dynamics (fissio ja fuusio) ja morfologian mitokondrioita (Karbowski ja Youle, 2003; Olichon et al., 2006; Brooks and Dong, 2007; Song et al., 2008; Autret and Martin, 2010; Silva ym., 2013; Sinha ja Manoj, 2019). Yksi näistä on optikusatrofia 1-proteiini (OPA1) (Olichon et al.,, 2006; Garcia ym., 2018; Lee ja Yoon, 2018). Tutkimukset ovat osoittaneet, että OPA1 on säädin mitokondrion sisemmän kalvon fuusio ja myös mitokondrioiden cristae remontin (Cipolat et al., 2006). Äskettäin Laforge ym. (2016) osoitti, että IKKa: n puuttuminen vaikutti opa1: n ilmentymiseen mitokondrioissa ja mitokondrioiden morfologiaan.
yllättäen Nan et alin tuoreessa tutkimuksessa. (2017), Tnf-reseptori 2 (TNFR2) stimulaatio löytyi edistää mitokondrioiden fusion kautta NF-kB-riippuvainen aktivointi OPA1 ilmaisun sydämen myosyyttien., Tärkeintä, TNFR2 aktivointi tässä tutkimuksessa protected sydämen myosyyttien vastaan stressiä upregulating OPA1 ilme. Antamalla pieninä pitoisuuksina eksogeeninen TNFa (0.5 ng/mL) ennen iskemia-reperfusion ilmestyi parantaa solujen eloonjäämistä, kun taas suuremmat pitoisuudet (10-20 ng/mL) led toksisia vaikutuksia soluissa.
NF-kB ja Apoptoosin Mitokondrioissa
Mitokondriot rooli on ohjelmoitu solun kuolema, tai apoptoosin on ollut tiedossa jo jonkin aikaa (Vihreä ja Reed, 1998; Wang ja Chen, 2015)., Tärkein rooli mitokondrioita on sukupolven ATP -; kuitenkin, toiseksi tärkein toiminto mitokondrioita on luultavasti valvoa solun kuolemaan. Miten mitokondrio tekee tämän? Jos mitokondrio epäonnistuu solukuoleman käynnistämisessä, seurauksena on usein syöpä. Solukuoleman säätelemiseksi mitokondriot siis integroivat eri lähteistä peräisin olevia signaaleja, joita kutsutaan apoptoosin luontaisiksi väyliksi. Osat NF-kB-aktiivisuus näyttäisi olevan yksi näistä signaaleista, vaikka TNFa, aktivaattori NF-kB on osa ulkoista polun apoptoosin., Ulkoista väyliä (death-reseptorin välittämää) on aloitettu ulkopuolella solu, kun taas sisäisiä väyliä apoptoosin välittyvät ja laukaisi mitokondrioissa.
pazarentzos et al. (2014), IkBa havaittiin vaikuttavan pro-apoptoottisen toimintaa, koska se esti anti-apoptoottisen NF-kB. Useimmissa soluissa NF-kB: n aktivoituminen johtaa solun kuolemanresistenssin laukaisevaan loppupään kohdegeenin ilmentymiseen (Luo et al., 2005). Tässä tutkimuksessa osoitettiin, että uusi apoptoositoiminto johtui IkBa-alayksiköstä, joka estää NF-kB: n aktivoitumista. Pazarentzos ym., (2014) havaitsivat, että IkBa paikantuu siihen OMM, jossa se on vuorovaikutuksessa jännite riippuvainen anioni-kanava (VDAC) ja mitokondrioiden hexokinase II (HKII) vakauttaa tämä monimutkainen ja estää Bax-välitteisen sytokromi c: n julkaisu apoptoosin. Bax kuuluu BCL-2-proteiiniperheeseen, jonka on osoitettu säätelevän ohjelmoitua solukuolemaa (Karbowski ym., 2006).
muutkin tutkimukset ovat vihjanneet NF-kB: n roolista mitokondrioiden apoptoosin suoremmassa säätelyssä. Tutkimuksessa Liu et al., (2004), estää NF-kB yksin makrofagit johti julkaisu sytokromi-c. Muista, että sytokromi-c on vastuussa shuttling elektroneja Monimutkainen III Monimutkainen IV ja että julkaisu sytokromi c solulimaan, aktivaattori caspases, on keskeinen askel käynnistää apoptoosin.
NF-kB ja Mitokondrioiden Hengitystä
Nuclear factor kappa B on osoitettu monissa tutkimuksissa edistää tuumorigeneesiin. Se, miten tämä tapahtuu, ei ollut aivan selvää. Uraauurtavassa tutkimuksessa Mauro et al., (2011), NF-kB havaittiin säätelevän mitokondriohengitystä paksusuolen karsinooman soluissa. Tässä he vahvistivat, että tämä NF-kB: n tehtävä tukahduttaa Warburgin vaikutuksen. Muista, että Warburg vaikutus (Vander Heiden et al., 2009) kuvaa havainto, että syöpäsolut ovat yleensä hyväksi aineenvaihduntaa glykolyysin kuin tehokkaampi oksidatiivinen fosforylaatio polku. Joten tässä tutkimuksessa kirjoittajat todennut, että NF-kB järjestää verkostot energia-aineenvaihduntaa ohjaamalla tasapaino glykolyysin hyödyntäminen ja mitokondrioiden hengitystä., Mielenkiintoista on, että he löysivät NF-kB: lle roolin aineenvaihdunnan sopeutumisessa normaaleissa soluissa ja syövässä. Niiden tulokset ehdotti lisäksi, että tukahduttaa mitokondrioiden aineenvaihduntaa perustettu syöpäsoluja estämällä NF-kB ja metformiini vähentää tuumorigeneesiin.
NF-kB ja Mitokondrioiden Geenien Ilmentyminen
Nuclear factor kappa B on tunnettu säädin geenien ilmentyminen – sekä negatiivisesti ja positiivisesti (Mattson et al., 2000). Kuitenkin, miten NF-kB säätelee tai vaikuttaa ydin koodattu mitokondrioiden geenin ilmentymä on vähemmän ymmärretty., Ihmisen mtDNA: lla on 37 geeniä, jotka koodaavat 13 polypeptidiä. On osoitettu, että mtDNA geenit koodi monta alayksiköiden kaikki 5 komplekseja elektroninsiirtoketju (JNE.), 2 rRNAs, ja 22 tRNAs. Tosin useimmat ETC-alayksiköt koodataan ydin-DNA: lla, johon NF-kB-aktiivisuus voi vaikuttaa (Calvo et al., 2016).
esimerkiksi sitä on väitetty (Cogswell ym., 2003), että NF-kB-reitti voi negatiivisesti säädellä COX III-alayksikköön liittyvää mitokondriogeenien ilmentymistä., COX III-alayksikkö on koodattu mtDNA ja on osa Monimutkaista IV mitokondrioiden JNE. Se toimii Katalyyttisenä alayksikkönä kompleksissa IV, joka on mitokondrioiden hapenkulutukseen liittyvä kompleksi. Tutkimuksessa Cogswell et al. (2003) NF-kB-aktivaation Mukauttaminen johti sekä COX III: n että sytokromi b mRNA: n ilmentymisen menetykseen. Muut tutkimukset tukevat rooli NF-kB sääntely lisää mitokondrioiden geenit, kuten COX minä, ja Cytb (Psarra ja Sekeris, 2008, 2009; Barshad et al., 2018b)., Lisäksi NF-kB p65-alayksikkö alhaisempia mtDNA-koodattu CytB mRNA, mahdollisesti sitovat D-loop ihmisen soluissa ilman p53 (Johnson et al., 2011). Kaiken kaikkiaan nämä tulokset viittaavat siihen, että NF-kB-signalointi voi vaikuttaa hengitysteiden entsymaattiseen aktiivisuuteen jne.
NF-kB Välittää Aß Aiheuttama Toimintahäiriö Mitokondrioissa
Alzheimerin tauti (AD) liittyy build-up Aß muistolaatat ja/tai ulkonäkö neurofibrillary tangles (NFTs) tietyillä aivojen alueilla (Duyckaerts et al., 2009)., Kiistaa on kuitenkin siitä, onko Aß AD: n aiheuttaja vai korreloiko Aß vain ikääntymisen kanssa. Kertyvät todisteet (Aliev ym., 2009; Correia ym., 2012; Cadonic et al., 2016; Cardoso ym., 2017; Djordjevic et al., 2017) myös nyt pisteitä muutoksia aivojen aineenvaihduntaa vetämänä mitokondrioiden toimintahäiriöitä prosessina, keski-monien ikääntymiseen liittyvien hermoston häiriöt mukaan lukien AD. Lisäämällä tämä näyttö on myös arvonalentumiset entsymaattinen aktiivisuus proteiini kompleksit JNE ja muutoksia antioksidantti entsymaattinen aktiivisuus (Kolosova et al.,, 2017) AD. Erityisesti kompleksiseen IV aktiivisuuteen on osoitettu vaikuttavan negatiivisesti AD (Mutisya et al., 1994).
Shi et alin tuoreessa tutkimuksessa. (2014), havaittiin, että aß heikensi mitokondrioiden toimintaa NF-kB-signaloinnin kautta. Lisäksi Shi et al. (2014) osoitti tässä, että Aß vähensi COX III-alayksikön ilmaisua NF-kB-reitillä., Tärkeintä, poistaa mahdollisuuden, että IkBa oli fosforyloitu mukaan Aß sytoplasmassa (ja sitten kuljetetaan mitokondrioita), eristetty mitokondriot olivat rauhoitettuna Aß läsnäolo (tai puuttuminen) ja NF-kB-esto, eli BAY11-7082. Täällä he löysivät Aß aiheuttama fosforylaation ja hajoaminen IkBa eristyksissä mitokondrioita.
Nämä löydökset on myös merkittäviä vaikutuksia AD hoito on osoituksena viimeaikaiset tutkimukset Lumi et al. (2018) ja kuten muissa vastaavissa tutkimuksissa (Djordjevic ym., 2017; Adlimoghaddam et al.,, 2019), jotka viittaavat NF-kB-signaloinnin kohdistamiseen mitokondrioihin, voi olla terapeuttista arvoa. Esimerkiksi lumessa ym.’s opinto -, kreatiini – tunnettu modulaattori mitokondrioiden toiminta (Tarnopolsky ja Beal, 2001), oli osoittanut, lisätä ja positiivisesti muuttaa proteiinin tasot CaMKII, PSD-95, ja Monimutkainen 1 alayksikön kreatiini ruokitaan hiiret, ottaa huomioon, että NF-kB estävä IkB-alayksikkö oli vähentynyt. Ylimääräisiä käsittelyssä kreatiini on potentiaalinen terapeuttinen vaikutus mitokondrioiden toimintaa ja mitokondrioiden häiriöt tai muut neurologiset häiriöt nähdä, tutkimukset ja arviot Matthews et al., (1998), Klivenyi ym. (1999), Tarnopolsky and Beal (2001), Hersch ym. (2006), Rodriguez ym. (2007) ja Beal (2011).
NF-kB: n rooli tulehduksessa ja mitokondrioiden aineenvaihdunnassa
lisääntyvä tieto (Lamas et al., 2003; Mauro ym., 2011; Moretti ym., 2012) viittaavat siihen, että tulehduksellisten prosessien välittäjänä toimiva NF-kB-signalointi toimii myös energia-aineenvaihdunnan säätelijänä ja integraattorina. Zhong et alin tuoreessa tutkimuksessa. (2016), NF-kB: n osoitettiin rajoittavan tulehdusaktivaatiota poistamalla vaurioituneet mitokondriot., Yllättävää, NF-kB ilmestyi sekä prime NLRP-3 inflammasome aktivointi-ja myös estää liiallista tulehdusta ja hillitty NLRP-3 inflammasome activation; vaikka mekanismi turvalaite oli huonosti määritelty. Täällä se oli arveltu, että lisäksi NF-kB on aktivaattori tulehduksellinen geenejä, se toimi myös tässä tutkimuksessa rajoittamalla NLRP3 inflammasome activation ja IL-1β tuotanto. Lisäksi todettiin, että p62 induktio oli vastuussa inflammasome estävää toimintaa NF-kB., Näyttää siltä, että NF-kB voi hillitä omia tulehdus makrofagit edistämällä p62 välittämä poistaminen vaurioitunut mitokondrioita (mitophagy) jälkeen makrofagit vuorovaikutuksessa eri NLRP3 inflammasome aktivaattoreita.
Johtopäätös
Yli 10 vuotta sitten, NF-kB havaittiin mitokondrioissa. Yllättävää kyllä, niin tärkeä transkriptio tekijä, on edistytty vain vähän apua erityisiä rooleja NF-kB vaikuttavat mitochondrion., Joissakin tutkimuksissa, kuten edellä on kuvattu, tehdä, toimittaa todisteita NF-kB vuonna mitokondrioiden dynamiikka, apoptoosin, hengityksen ohjaus, geenien ilmentyminen, ja mekanismeja taudin (Kuva 1). Näiden tulosten päällekkäisyys ja yleinen validointi ovat kuitenkin edelleen tarpeen muissa laboratorioissa. Lisää tietoa voi päätellä siitä, että muut transkriptio tekijät, joilla on vaikutuksia ydinalan geenien, kuten AP-1, p53, CREB -, c-Myc, Wnt13, Dok-4, HMGA1, ja c-Src on havaittu myös mitokondrioissa (Psarra ja Sekeris, 2008)., Mielenkiintoista, sitova sivustoja mitokondrioiden genomin (homologisia niiden sitova sivustoja ydin-DNA: ta) joitakin näistä tekijät on määritetty (Psarra ja Sekeris, 2008), jossa roolit mitokondrioiden transkriptio ja apoptoosin epäillään ja näyttää joitakin yleisiä malleja toiminnan. Esimerkiksi argumentti voidaan tehdä, että osa näistä tekijöistä (NF-kB, CREB, ja AP-1) sitoudu mitokondrioiden genomeja ja useimmiten heikentää mitokondrioiden geenien ilmentyminen (Blumberg ym., 2014), samalla kun sillä on stimuloivia vaikutuksia ydingeenien transkriptioon., On kuitenkin selvää, että tarvitaan enemmän työtä paitsi täsmällisten toimintaroolien löytämiseksi, myös sen selvittämiseksi, onko yleisiä toimintamalleja todella olemassa.
sen Jälkeen, kun maanmittauksen tämä kirjallisuus, se tulee myös ilmi, että NF-kB: n rooli sääntelyn mitokondrioiden hengitystä on syvällisiä vaikutuksia ja osoittaa monimutkaisuuden taso ei ole aiemmin arvostettu. Esimerkiksi Mauro et al. (2011) data-perustaa asema NF-kB-aineenvaihdunnan sopeutuminen normaaleja soluja ja syövän, ja myös ehdottaa seurauksia muiden tautitilojen, kuten AD., Lisäksi, koska NF-kB voi hillitä omaa tulehdusta, kuten Zhong et al. (2016), ei vain ole yllättävää, mutta edelleen esimerkki monimutkaisuudesta NF-kB signalointi mitokondriotoiminnassa.
tässä katsauksessa tutkittiin NF-kB: n roolia mitokondrioiden toiminnassa, ja näyttää siltä, että alan tutkimus on lisääntymässä. Vaikeuttaa tuloksia, vaikka on havainto, että useat tekijät ovat pelissä samankaltaisia rooleja mitokondrioiden toimintaa ja niin yksityiskohtaisia selvityksiä kunkin tekijä ovat tarpeen., Lopuksi voimme esittää uudelleen kysymyksen – mitä NF-kB tekee mitokondriossa ja sille? Välitön ja lyhennetty vastaus olisi – paljon!
Kirjoittaja Maksut
kirjoittaja loi aiheen ja kirjoitti käsikirjoituksen.
Rahoitus
Tämän työn tukivat rahoitusta Kanadan Institutes of Health Research (yhteisön rauhaa), Kanadan Maatalouden Kumppanuus (YMP), St. Boniface Hospital Research Foundation, Alzheimer Society of Manitoba -, Tutkimus-Manitoba, arvoisa Douglas ja Patricia Everett, ja Royal Canadian Properties Limited Lahjoitusvarat Rahasto.,
eturistiriita Lausunto
kirjoittaja vakuuttaa, että tutkimus on tehty ilman mitään kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdollisia eturistiriitoja.
Kiitokset
kirjoittaja haluaa kiittää Tohtori Grant Luukku tarkistaa käsikirjoituksen.
Hayden, M. S., ja Ghosh, S. (2004). Signalointi NF-kappabille. Geenit Dev. 18, 2195–2224.
PubMed Abstrakti | Google Scholar
Wang, X. ja Chen, X, J. (2015)., Sytosoliverkosto tukahduttaa mitokondrioiden välittämän proteostaattisen stressin ja solukuoleman. Luonto 524, 481-484. doi: 10.1038/nature14859
PubMed Abstrakti | CrossRef Koko Teksti | Google Scholar