Oppimisen Tavoitteet
- Määritä korroosiota
- Luettelo joitakin menetelmiä, joita käytetään estämään tai hidastamaan korroosiota
Korroosio on yleensä määritelty hajoaminen metallien koska sähkökemiallinen prosessi. Ruosteen muodostuminen raudalle, hopealle tervattu ja kuparille kehittyvä sinivihreä patina ovat kaikki esimerkkejä korroosiosta., Korroosion kokonaiskustannukset ovat Yhdysvalloissa merkittävät, arvioiden mukaan yli puoli biljoonaa dollaria vuodessa.
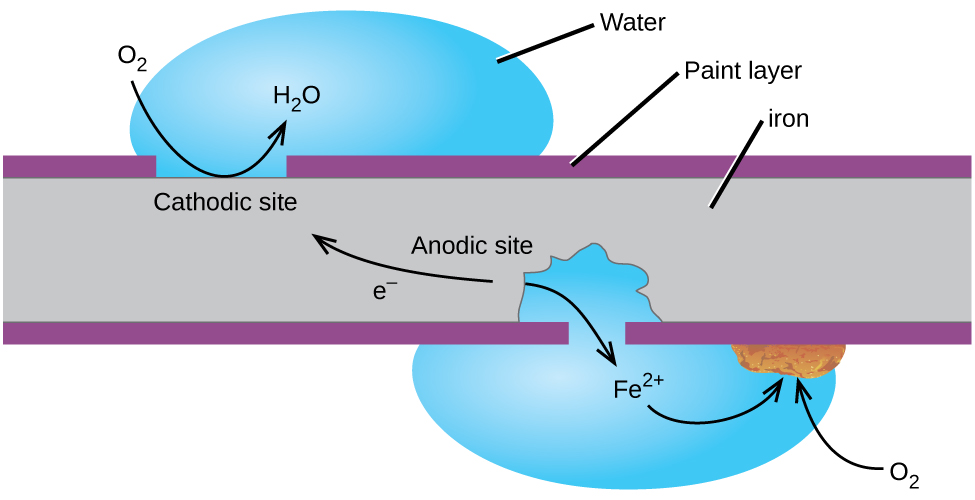
Ehkä tutuin esimerkki korroosiosta on muodostumista ruostetta rautaa. Rauta ruostuu, kun se altistuu hapelle ja vedelle. Raudan ruostumisen päävaiheet näyttävät käsittävän seuraavat (kuva 2). Kun rauta altistuu ilmakehälle, se hapettuu nopeasti.
elektronit vähentävät happamissa liuoksissa happea ilmassa.
Mitä me kutsumme ruoste on hydratoitu rauta(III) oksidi, joka muodostuu, kun rauta(II) ioneja reagoi edelleen hapen kanssa.,
vesimolekyylien määrää on vaihteleva, joten se edustaa x. Toisin patina kupari, muodostumista ruostetta ei luoda suojaava kerros ja niin korroosio rauta jatkuu niin ruoste hiutaleet pois ja paljastaa tuore rauta tunnelma.
Yksi tapa pitää raudan korroosiota on pitää se maalata. Maalikerros estää ruosteen muodostumisen kannalta välttämättömän veden ja hapen joutumisen kosketuksiin raudan kanssa. Niin kauan kuin maali pysyy ehjänä, rauta on suojattu korroosiolta.,
muihin strategioihin kuuluu raudan seostaminen muiden metallien kanssa. Esimerkiksi ruostumaton teräs on enimmäkseen rautaa, jossa on hieman kromia. Kromi pyrkii kerääntymään lähelle pintaa, jossa se muodostaa rautaa suojaavan oksidikerroksen.
sinkitty tai sinkitty rauta käyttää erilaista strategiaa. Sinkki hapettuu helpommin kuin rauta, koska sinkillä on pienempi pelkistyspotentiaali. Koska sinkin pelkistyspotentiaali on pienempi, se on aktiivisempi metalli. Näin ollen vaikka sinkkipinnoite naarmuuntuu, sinkki hapettuu vielä ennen rautaa., Tämä viittaa siihen, että tämän lähestymistavan pitäisi toimia muiden aktiivisten metallien kanssa.
toinen tärkeä tapa suojata metallia on tehdä siitä katodi galvaanisessa solussa. Tämä on katodisuojaus ja sitä voidaan käyttää muihin metalleihin kuin vain rautaan. Esimerkiksi maanalaisten rautavarastojen ja-putkien ruostumista voidaan estää tai vähentää huomattavasti liittämällä ne aktiivisempaan metalliin, kuten sinkkiin tai magnesiumiin (kuva 3). Tätä käytetään myös suojaamaan vedenlämmittimien metalliosia., Aktiivisempi metallit (alempi pelkistyspotentiaali) kutsutaan suoja-anodit, koska he saavat käyttää, koska ne syövyttävät (hapettua) anodi. Suojattava metalli toimii katodina, eikä siten hapeta (syövytä). Kun anodeja seurataan ja vaihdetaan säännöllisesti, raudan varastosäiliön käyttöikä voi pidentyä huomattavasti.
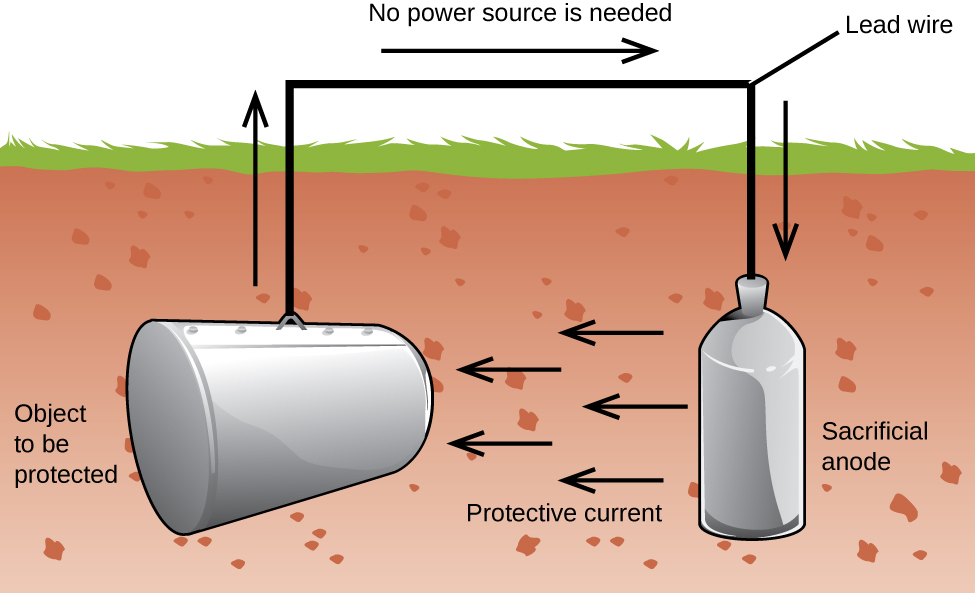
Korroosio on hajoamista metalli aiheuttama sähkökemiallinen prosessi. Vuosittain käytetään suuria rahasummia korroosion vaikutusten korjaamiseen tai estämiseen. Jotkin metallit, kuten alumiini ja kupari, tuottavat suojakerroksen, kun ne syövyttävät ilmassa., Ohut kerros, joka muodostaa pinnalle metalli estää hapen kanssa kosketuksiin enemmän metallin atomit ja siten ”suojaa” loput metallia enemmältä korroosiolta. Rauta syövyttää (muodostaa ruostetta) altistuessaan vedelle ja hapelle. Ruoste, joka muodostaa rautametallihiutaleita pois, paljastaen tuoretta metallia, joka myös syövyttää. Yksi tapa estää tai hidastaa korroosiota on päällystämällä metalli. Pinnoite estää veden ja hapen yhteyttä metallia. Maali tai muut pinnoitteet hidastavat korroosiota, mutta ne eivät ole tehokkaita, kun naarmuuntunut., Sinkitty tai sinkitty rauta hyödyntää sitä, että sinkki hapettuu todennäköisemmin kuin rauta. Niin kauan kuin pinnoite pysyy, vaikka naarmuuntunut, sinkki hapettuu ennen rautaa. Toinen menetelmä metallien suojaamiseksi on katodisuojaus. Tässä menetelmässä, helposti hapettunut ja edullinen metalli, usein sinkkiä tai magnesiumia (uhrautuva anodi), on sähköisesti liitetty metalli, jota on suojeltava. Aktiivisempi metalli on uhrianodi, ja se on galvaanisessa solussa oleva anodi. ”Suojattu” metalli on katodi, ja se pysyy hapettumattomana., Katodisuojauksen yksi etu on, että uhrianodia voidaan tarvittaessa seurata ja korvata.,
Sanasto
katodinen suojaus tapa suojata metallia käyttämällä uhrautuva anodi ja tehokkaasti tehden metalli, joka tarvitsee suojelua katodi, mikä estää sen hapettumista korroosio hajoaminen metalli läpi sähkökemiallinen prosessi, galvanoitu rauta tapa suojella rauta peittämällä se sinkki, joka hapettaa ennen rauta -, sinkki-kullattu rauta uhrautuva anodi aktiivisempi, edullinen metalli, jota käytetään anodina vuonna katodinen suojaus; usein valmistettu magnesium tai sinkki
Ratkaisut
Vastauksia Kemia Luvun Loppua Harjoituksia
2., Mg ja Zn
4. Molemmat esimerkit liittyvät katodisuojaan. (Uhrianodi) anodi on metalli, joka syövyttää (hapettuu tai reagoi). Raudan (-0,447 V) ja sinkin (-0,7618 V) osalta sinkillä on negatiivisempi standardivähennyspotentiaali ja se toimii siten anodina. Raudan ja kuparin (0,34 V) osalta raudalla on pienempi vakiovähennyspotentiaali ja se syövyttää (toimii anodina).
6., Vaikka vähentäminen mahdollisuudet litium olisi tehdä se kykenee suojaamaan muita metalleja, tämä suuri potentiaali on myös osoitus siitä, miten reaktiivinen litium on; se on spontaani reaktio useimmat aineet. Tämä tarkoittaa sitä, että litium reagoi nopeasti muiden aineiden kanssa, jopa ne, jotka eivät hapetu metalli on yrittää suojella. Tämänkaltainen reaktiivisuus tarkoittaa, että uhrianodi ehtyisi nopeasti, ja se on korvattava usein. (Vapaaehtoinen lisäsyy: palovaara veden läsnä ollessa.)