1913 Bohr malli vetyatomi on korvattu Schrodingerʹs aalto mekaaninen malli vuonna 1926. Kuitenkin, Bohrʹs malli on edelleen kannattavasti opetti tänään, koska sen käsitteellinen ja matemaattinen yksinkertaisuus, ja koska se on otettu käyttöön useita keskeisiä kvantti-mekaaninen ideoita, kuten kvanttiluku, kvantisointi havaittavia ominaisuuksia, quantum jump ja pysyvä tila.,
Bohr laskettu moninaiset sallittu electron energioita tasapainottamalla mekaanisia voimia (keskihakuinen ja electron‐ydin) on elektronin suorittamista pyöreä kiertoradan säde R noin ydin, ja sitten arbitarily quantizing sen impulssimomentti. Lopuksi fiat hän julisti, että elektroni oli ei‐säteilevän pysyvä tila, koska kiertoradalla (nopeuttaa) vastaa säteilee energiaa ja romahtaa osaksi vastakkaisesti maksu ydin.,
Vuonna 1924 de Broglie oletettujen aalto‐hiukkanen kaksinaisuus elektronin ja muita massiivisia hiukkasia, mikä tarjoaa mahdollisuuden poistaa joitakin arbitariness alkaen Bohrʹs malli. Esimerkiksi elektronilla, jolla on aaltoominaisuuksia, on rakentava ja tuhoisa häiriö. Kuten näkyy tämä johtaa luonnollisesti kvantisointi elektronin liikemäärän ja liike-energian, ja näin ollen moninaiset saa energiaa valtioiden electron suhteessa ydin., Tässä esitelty vetyatomin de Broglie‐Bohr-malli kohtelee elektronia hiukkasena renkaassa, jolla on aaltomaisia ominaisuuksia.
\
de Broglien hypoteesi, jonka mukaan aineella on aaltomaisia ominaisuuksia.
\
seurauksena de Broglieʹs hypoteesi; kiinteä useita aallonpituuksia on mahduttava ympärysmitta kiertoradalla. Tämä esittelee kvanttiluvun, jolla voi olla arvot 1,2,3,… N = 4 elektronin tila on esitetty alla.,
\
Korvaaminen ensimmäinen yhtälö toiseen yhtälöön paljastaa, että vauhtia on kvantittunut.
\
Jos momentum on kvantisoitu, niin on myös kineettinen energia.
\
eli kokonaisenergia kvantitoituu. Toinen termi on elektroni‐protoni sähköstaattinen potentiaalienergia.
kvanttimekaniikan tulkinta näistä ʺBohr orbitsʺ on, että ne ovat paikallaan toteaa. Huolimatta siitä, että käytämme ilmaisua kineettinen energia, joka merkitsee elektronin liikettä, ei ole liikettä., Elektroni vie kiertoradan hiukkasaaltona, se ei kierrä ydintä. Jos se kiertäisi klassisessa mielessä, se säteilisi energiaa ja romahtaisi nopeasti ytimeen. Aineen stabiilisuus edellyttää selvästi kineettisen energian kvanttimekaanista versiota.
maahan valtion energia-ja kiertoradan säde, elektroni vety-atomi on löytänyt piirtämällä energian funktiona kiertoradan säde. Maatila on pienin kokonaisenergiakäyrässä., Luonnollisesti calculus voidaan saada samaa tietoa minimoimalla energia suhteessa kiertoradan säde. Graafisen menetelmän etuna on kuitenkin atomivakauden valaiseminen.
vakiot: elektronin varaus, elektronin massa, Planckin vakio, tyhjiö permitivity.
kvanttiluku ja konversiofakta metrien ja pikometrien sekä joulien ja attojoulien välillä.
\
\
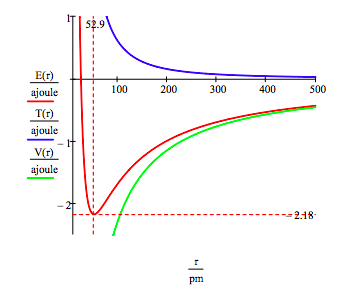
Tämä kuva osoittaa, että atomi vakaus liittyy tasapaino potentiaali-ja liike-energiaa., Elektroni on piirretty kohti ydin, jonka houkutteleva potentiaalienergia vuorovaikutus (~ -1/R), mutta on estynyt romahtamassa osaksi ydin, jonka erittäin suuri kineettinen energia (~1/R2) liittyy pieni kiertoradat.
Kuten alla, graafinen lähestymistapaa voidaan käyttää myös löytää electronic innoissaan toteaa.
\
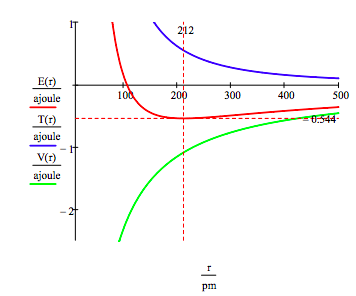
Kuten aiemmin mainittiin moninaiset sallittu electron energiat voidaan saada myös minimoimalla energiaa suhteessa sen kiertoradan säde. Tämä menettely tuottaa,