Suhde Paine ja Tilavuus: Boylen Laki,
Koska paine kaasua lisää, kaasun tilavuuden vähenee, koska kaasun hiukkaset joutuvat lähemmäksi toisiaan. Vastaavasti kaasun paineen laskiessa kaasun tilavuus kasvaa, koska kaasuhiukkaset voivat nyt siirtyä kauemmas toisistaan., Sää ilmapalloja saada suurempia kuin ne nousevat läpi tunnelma alueilla alhaisempi paine, koska kaasun tilavuuden on lisääntynyt; että on, ilmakehän kaasu aiheuttaa vähemmän painetta pinnan ilmapallo, joten sisustus kaasu laajenee, kunnes sisäiset ja ulkoiset paineet ovat yhtä suuret.
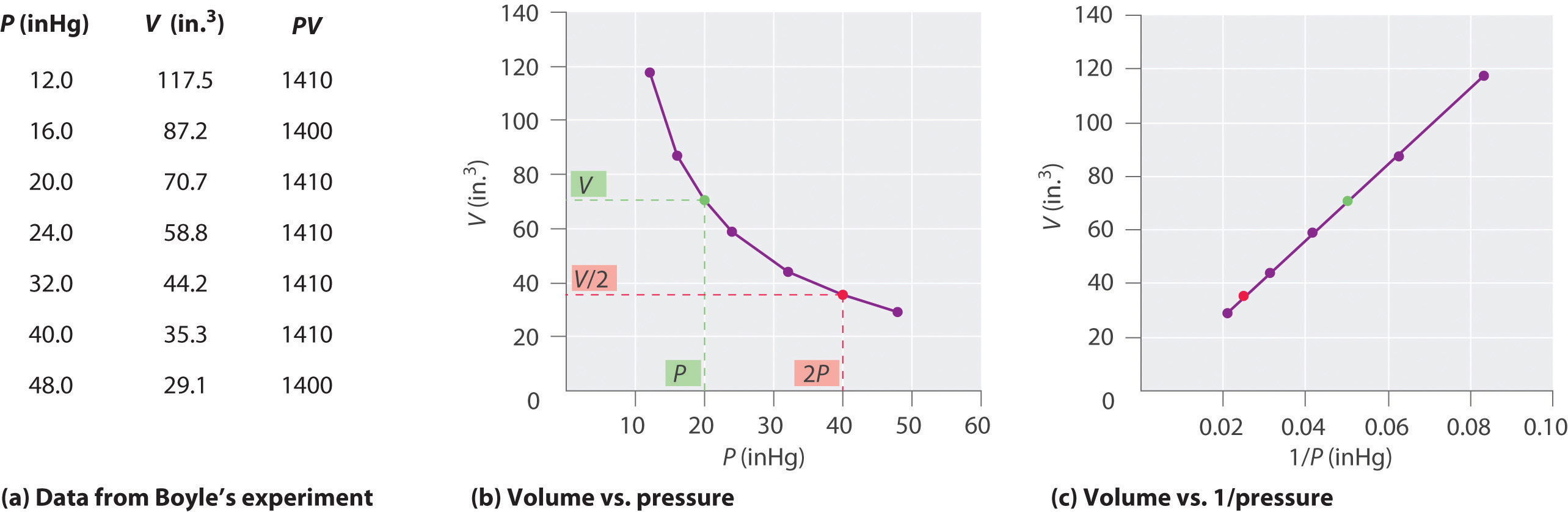
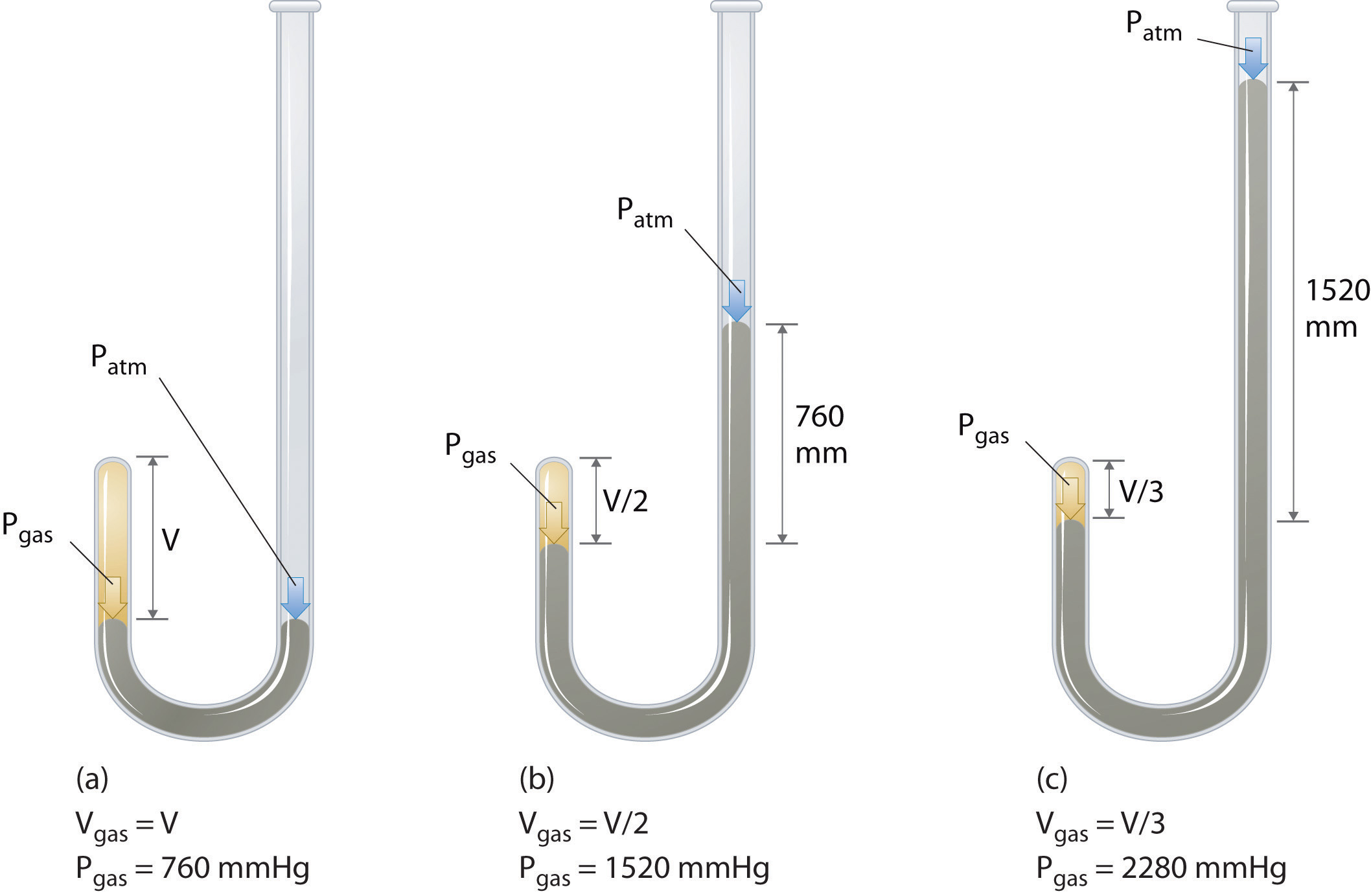
Irlannin kemisti Robert Boyle (1627-1691) suorittaa joitakin pian kokeita, jotka määritellään määrällinen suhde paine ja tilavuus kaasua. Boyle käytti J-muotoista putkea, joka oli osittain täytetty merkuriuksella, kuten kuvassa \(\PageIndex{1}\) esitetään., Näissä kokeissa elohopeapylvään yläpuolelle jää pieni määrä kaasua tai ilmaa, ja sen tilavuus mitataan ilmanpaineessa ja vakiolämpötilassa. Sen jälkeen avoimeen käsivarteen kaadetaan lisää elohopeaa kaasunäytteen paineen lisäämiseksi. Paine kaasu on ilmakehän paine plus ero korkeuksiin elohopeaa pylväät, ja tuloksena tilavuus on mitattu. Tämä prosessi toistetaan, kunnes joko avoimessa käsivarressa ei ole enää tilaa tai kaasun tilavuus on liian pieni mitattavaksi tarkasti., Esimerkiksi Boylen omista kokeista saatavat tiedot voidaan piirtää monella tavalla(Kuva \(\PageIndex{2}\)). Yksinkertainen juoni \(v\) vastaan \(p\) antaa käyrän nimeltä hyperbola ja paljastaa käänteisen suhteen paineen ja tilavuuden välillä: kun paine kaksinkertaistuu, tilavuus pienenee kertoimella Kaksi. Tämä suhde kahden määrät on kuvattu seuraavasti:
\
Jakamalla molemmat puolet \(P\), saadaan yhtälö, joka kuvaa käänteinen suhde välillä \(P\) ja \(V\):
\
tai
\
jos ∝ symboli luetaan ”on verrannollinen.”V: n vs. 1/P: n juoni on siten suora viiva, jonka kaltevuus on yhtälössä 6.2.1 ja yhtälössä 6.2.3 olevan vakion suuruinen. Jakamalla yhtälön 6.2.1 molemmat puolet V: llä P: n sijaan saadaan samanlainen suhde P: n ja 1/V: n välillä., Vakion numeerinen arvo riippuu kokeessa käytetyn kaasun määrästä ja lämpötilasta, jossa kokeet suoritetaan. Tämä suhde paine ja tilavuus tunnetaan Boylen laki, kun sen löytäjä, ja voidaan todeta seuraavaa: vakiolämpötilassa, määrä kiinteä määrä kaasu on kääntäen verrannollinen sen paineeseen.