Johdanto
Elektroneja ei ole kiinteä asema atomit, yhdisteitä ja molekyylejä (ks. kuva alla), mutta on todennäköisyyksiä on löytynyt tietyissä tiloissa (orbitaalit). Resonanssimuodot kuvaavat suurempien todennäköisyyksien alueita (elektronitiheydet). Tämä on kuin pitelisi hattua joko oikeassa kädessä tai vasemmalla. Termiä resonanssi sovelletaan, kun on olemassa kaksi tai useampia mahdollisuuksia., Kemistit käyttävät Lewisin diagrammeja kuvaamaan kovalenttisten entiteettien, kuten molekyylien ja polyatomisten ionien, rakennetta ja sidosta vastedes molekyyleihin. Monien molekyylien Lewis-Diagrammi ei kuitenkaan vastaa molekyylin havaittuja ominaisuuksia.
Esimerkiksi \(\PageIndex{1}\): Nitraatti-Ioni
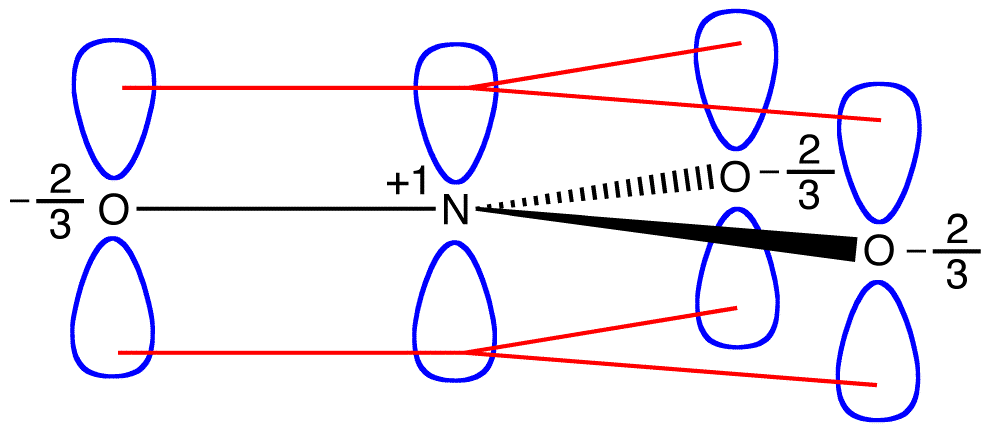
nitraatti-ioni, sen mukaan Lewis kaavio, on kahdenlaisia typpi-happi-joukkovelkakirjoja, yksi kaksoissidos ja kaksi yhden joukkovelkakirjoja, mikä viittaa siihen, että yksi typpi-happi-sidos nitraatti-ioni on lyhyempi ja vahvempi kuin muut kaksi., Myös Lewis rakenne merkitsee, suhteessa muodollinen maksu, että on olemassa kaksi happiatomia nitraatti-ioni, yksi virallisesti neutraali ja kukin muu kaksi laakeri virallisen vastaa -1. Kokeellisesti on kuitenkin kolme typpi-happi-sidoksia nitraatti-ioni on sama bond pituus ja sama bond energiaa, ja kolme happea atomit ovat erottamattomat. Lewis-Diagrammi ei selitä nitraatti-ionin rakennetta ja sidosta tyydyttävästi.
kaksi muuta Lewis-diagrammia voidaan piirtää nitraatti-Ionille.,
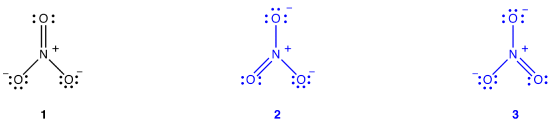
Kuitenkin, yksikään niistä ovat yhdenmukaisia havaitun ominaisuuksia nitraatti-ioni ja näin ollen, ei ole oikein kuvata nitraatti-ioni.
Esimerkiksi \(\PageIndex{2}\): Bentseeni
Bentseeni, sen mukaan Lewis kaavio, on kaksi hiili-hiili-sidoksen, kolme kaksoissidosta ja kolme yhden joukkovelkakirjoja, mikä viittaa siihen, että jokainen kolme hiili-hiili-sidoksia bentseeni on lyhyempi ja vahvempi kuin muut kolme. Kokeellisesti bentseenin kuudella hiilihiilisidoksella on kuitenkin sama sidoksen pituus ja sama sidosenergia., Lewis-Diagrammi ei selitä bentseenin rakennetta ja sidosta tyydyttävästi.
molekyylien attribuutti, jonka klassinen Lewis-Diagrammi ei vastaa havaittuja ominaisuuksia, on se, että niille voidaan luoda muita voimassa olevia Lewis-diagrammeja. Bentseenille voidaan piirtää vielä yksi Lewis-Diagrammi.

Kuitenkin, yksikään niistä ovat yhdenmukaisia havaitun ominaisuuksia bentseeni ja, näin ollen, ei ole oikein kuvata bentseeni.,
Resonanssi teoria on yritys selittää rakenne lajeja, kuten nitraatti-ioni tai bentseeniä, ei Lewis kaavio, joka on sopusoinnussa havaittu ominaisuuksia lajien. Resonanssiteorian suurin etu on se, että vaikka se perustuu tiukkaan matemaattiseen analyysiin, resonanssiteoriaa voidaan soveltaa onnistuneesti vedoten vähän tai ei lainkaan matematiikkaan. Resonanssiteoria selitetään alla käyttäen esimerkkinä nitraatti-Ionia.
Mukaan resonanssi teoria, rakenne nitraatti-ioni ei ole 1 eikä 2 eikä 3 mutta keskimäärin kaikki kolme, painotettu vakautta., Lewis kaaviot 1, 2 ja 3 ovat nimeltään resonanssi muotoja, resonanssi rakenteita, tai resonanssi rahoittajien nitraatti-ioni. Nitraatti-ionin rakenteen sanotaan olevan resonanssihybridi tai yksinkertaisesti resonanssimuotojen 1, 2 ja 3 Hybridi. Aina, kun se on tarpeen osoittaa rakenne nitraatti-ioni, resonanssi lomakkeet 1, 2 ja 3 on piirretty, yhdistetty kaksipäinen nuolia.,
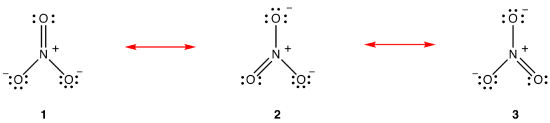
kolme resonanssi muotoja nitraatti-ioni, 1, 2, ja 3 ovat identtiset, joten ne on samaa vakautta ja edistää näin ollen myös hybridi., Koska tarkka, missä määrin kukin resonanssi muodossa nitraatti-ioni edistää hybridi on tiedossa, bond, jotta kunkin typpi-happi-sidoksen sekä virallista syytettä jokainen happiatomi hybridi voidaan määrittää helposti:
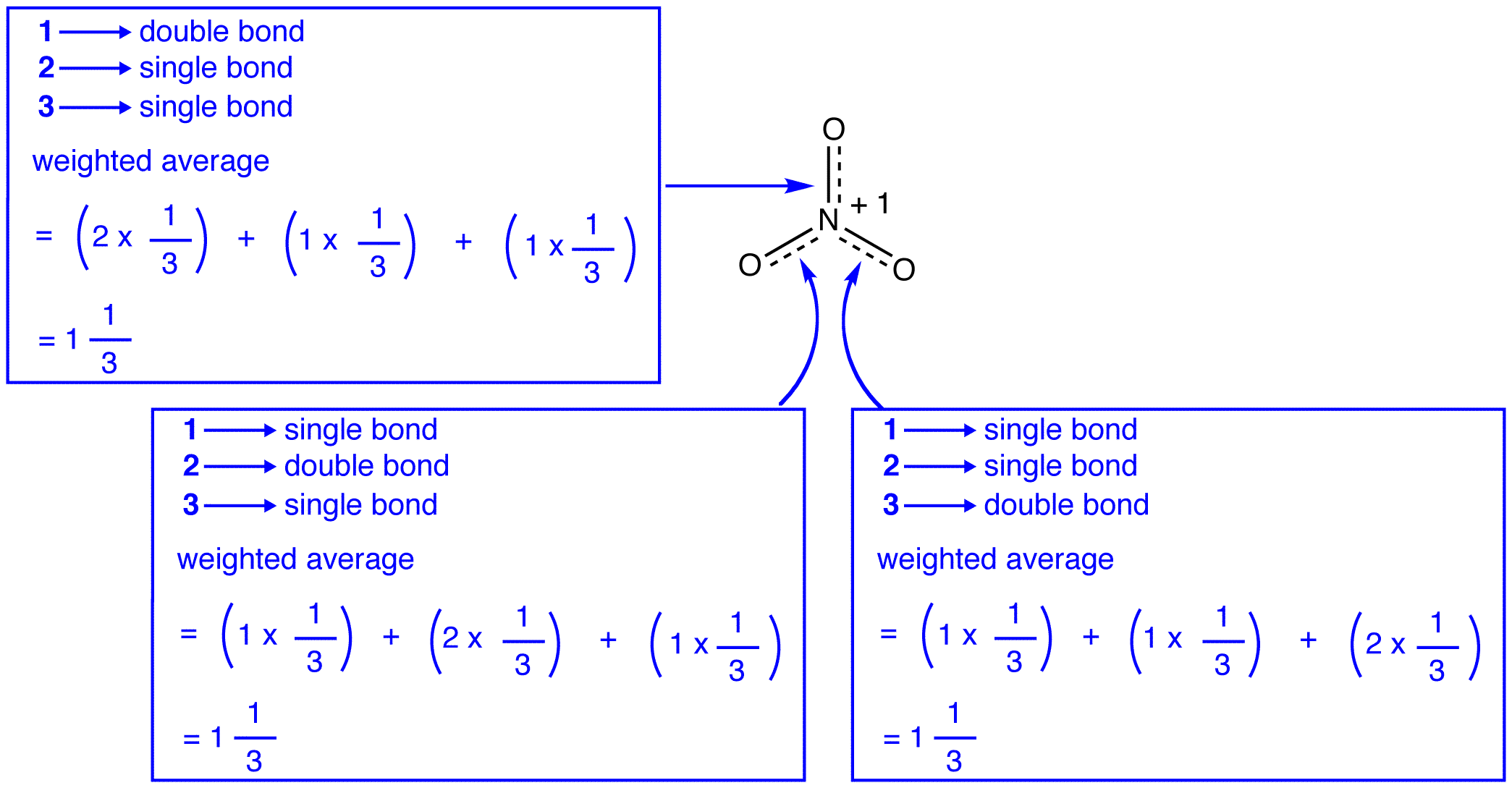
Mukaan resonanssi teoria, jokainen bond nitraatti-ioni on yksi ja yksi-kolmas bond, mikä on yhdenmukainen havainto, että kolme joukkovelkakirjojen nitraatti-ioni on sama bond pituus ja sama bond energiaa.,
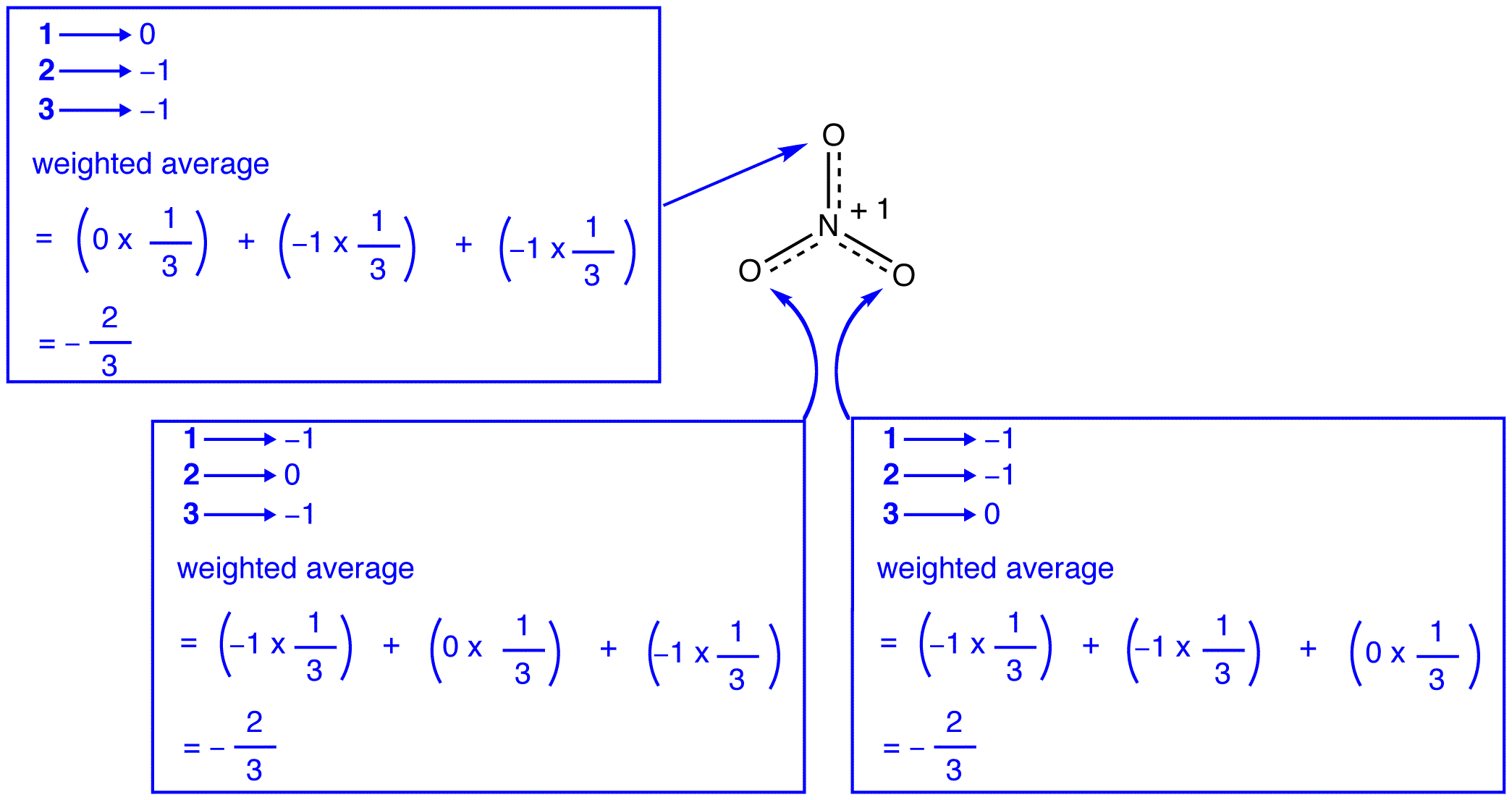
Mukaan resonanssi teoria, jokainen happiatomi vuonna nitraatti-ioni on virallisen syytteen -2/3, joka yhdessä siihen, että kolme typpi-happi-sidokset ovat samat, on yhdenmukainen havainto, että kolme happiatomia nitraatti-ioni ovat erottamattomat. Nitraatti-ionin jokaisessa resonanssimuodossa on kaksi \(\pi\) elektronia, ja ne jaetaan vain kahdella atomilla. Elektronin, jonka jakaa vain kaksi atomia, sanotaan olevan lokalisoitu., Näin ollen nitraatti-ionin jokaisessa resonanssimuodossa olevat kaksi \(\pi\) elektronia ovat lokalisoituja. Nitraatti-ioni, edustaa hybridi, on kaksi \(\pi\) elektronit:
- # elektronit yksi \(\pi\) side = 2
- # elektronit kolmasosa \(\pi\) side = 2/3
- # elektronit kolme = 3 x (2/3) = 2
kaksi \(\pi\) elektroneja nitraatti-ioni on jaettu yhteensä neljä atomien, yhden typpiatomin ja kolme happea atomit. Yli kahden atomin jakaman elektronin sanotaan delokalisoituvan. Näin nitraatti-ionissa olevat kaksi \(\pi\) elektronia delokalisoituvat., \(\Pi\) elektronien delokalisoituminen nitraatti-ionissa edellyttää, että neljä atomia ovat samalla tasolla, jolloin niissä olevat p-orbitaalit menevät sivusuunnassa päällekkäin.,
Jos energia nitraatti-ioni olivat painotettu keskiarvo energiat sen kolme resonanssi muotoja, aivan kuten rakenne nitraatti-ioni on painotettu keskiarvo rakenteita sen kolme resonanssi muotoja, se olisi yhtä suuri kuin energia yksi kolme samanlaista resonanssi muodossa:
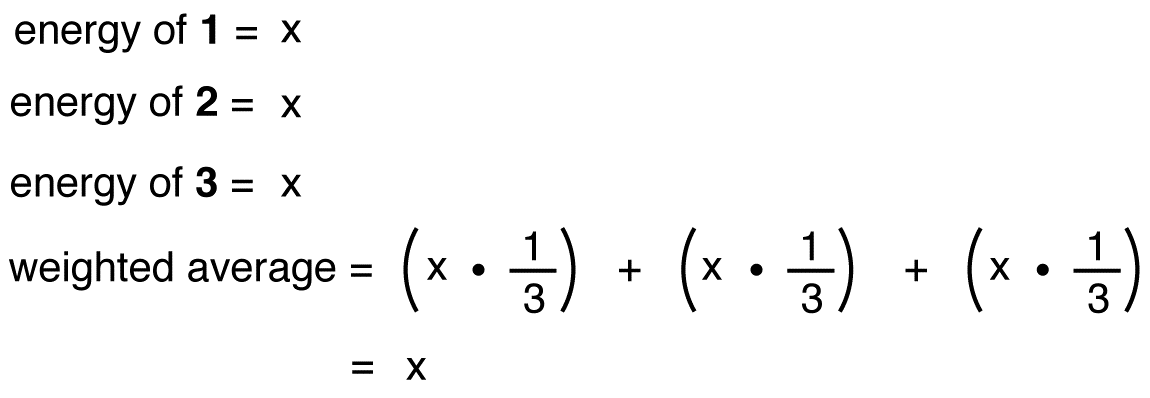
Jos energia hybridi oli yhtä suuri resonanssi muodossa, kun otetaan huomioon, että kaikki kemialliset yksiköt (alkeishiukkaset, atomit, molekyylit, jne.,) luonnostaan taipumus olla pienin mahdollinen energia valtio, ei olisi mitään etua nitraatti-ioni olemassa kuin hybridi; se voi yksinkertaisesti olla olemassa kuin resonanssi muodossa. Koska nitraatti-ioni on kuin hybridi, ei resonanssi muodossa, se voidaan päätellä, että energia-hybridi on pienempi kuin jokin resonanssi muotoja.
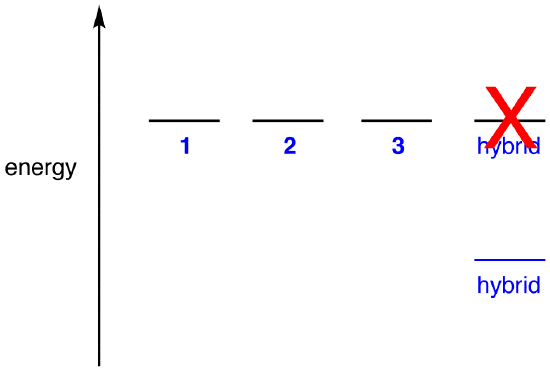
Mukaan resonanssi teoria sitten, energia molekyyli on pienempi kuin alin-energian resonanssi muodossa., Koska nitraatti-ioni on pienempi energian ja, näin ollen, on vakaampi kuin mikään sen resonanssi muotoja, nitraatti-ioni on sanottu olevan resonanssi vakiintunut.
Yleisiä Harhaluuloja.
On olemassa kaksi väärinkäsityksiä resonanssi teoria keskuudessa alussa opiskelijat, todennäköisesti johtuu kirjaimellinen tulkinta sanasta resonanssi. Ne on kuvattu alla käyttäen esimerkkinä nitraatti-Ionia.
Harhaluulo 1: nitraatti-ioni on olemassa resonanssi muodossa 1 hetken ja sitten muutokset joko resonanssi muodossa 2 tai resonanssi muodossa 3, joka interconvert tai palauta 1.,
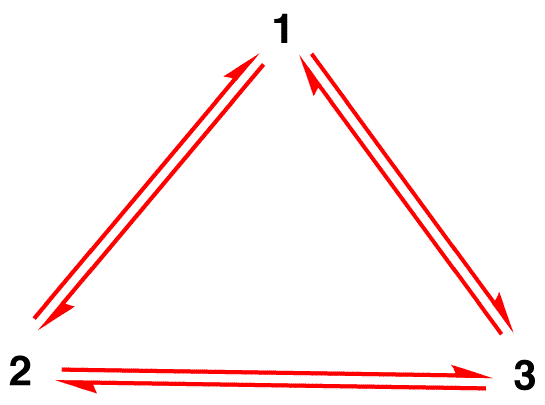
rakenne nitraatti-ioni ei ole 1 tai 2 tai 3, mutta hybridi-ja ei muutu ajan myötä, ellei meneillään reaktio.
Väärinkäsitys 2: näytteen nitraatti-ionit, tietyllä hetkellä, kolmasosa ioneja olemassa resonanssi muodossa 1, toinen kolmasosa kuten resonanssi muodossa 2, ja loput yksi kolmasosa, koska resonanssi-lomake 3.
näytteen nitraatti-ionit, tietyllä hetkellä, kaikki ionit on sama rakenne, joka on hybridi.,
Muulit ja Sarvikuono
klassinen analogisesti käytetään selventämään näiden kahden väärinkäsityksiä on muuli (Morrison, R. T.; Boyd, SAIRAANHOITAJAMME. Orgaaninen Kemia, viides painos, Allyn and Bacon: Boston, 1987, pg. 373). Biologisesti muuli on hevosen ja aasin risteymä. Tämä ei tarkoita sitä, että muuli muistuttaa hetken hevosta ja muuttuu sen jälkeen aasin kaltaiseksi. Muulin ulkonäkö on yhdistelmä hevosen ja aasin ulkonäöstä eikä muutu ajan myötä. Se ei myöskään tarkoita, että laumassa jotkut muulit muistuttaisivat hevosta ja toiset Aasia., Laumassa kaikki muulit ovat samannäköisiä, mikä on hevosen ja aasin yhdistelmä. Tämän analogian heikkous on se, että hevosia ja aaseja on olemassa, kun taas resonanssimuodot ovat puhtaasti hypoteettisia. Morrisonissa ja Boydissa mainittu parempi vertaus on sarvikuono. Nähdessään sarvikuonon voisi kuvailla sitä Lohikäärmeen ja yksisarvisen hybridiksi, kahdeksi olennoksi, joita ei ole olemassa.