Introducción
el factor nuclear kappa B (NF-kB) es un antiguo factor de transcripción de proteínas (Salminen et al., 2008) y considerado un regulador de la inmunidad innata (Baltimore, 2009). La vía de señalización NF-kB enlaza las señales patógenas y las señales de peligro celular organizando así la resistencia celular a los patógenos invasores., De hecho, una gran cantidad de estudios han demostrado que NF-kB es un centro de red responsable de la señalización biológica compleja (Albensi y Mattson, 2000; Kaltschmidt y Kaltschmidt, 2009; Karin, 2009). Con este fin, se ha hipotetizado que NF-kB es un regulador maestro de cascadas bioquímicas conservadas evolutivamente (Mattson et al., 2000). Otros factores también se translocan en las mitocondrias y están involucrados en la modulación de la expresión (Barshad et al., 2018a), pero no son el foco de esta revisión., El propósito de esta revisión es tratar de entender cómo la actividad de NF-kB contribuye a la función mitocondrial. Se supone que el lector ya tiene una comprensión de la biología mitocondrial básica. En el caso de estudios posteriores, el lector se remite a muchos estudios y revisiones excelentes sobre la estructura y función mitocondrial (Hall, 1979; Fox, 1982; Roger y Silberman, 2002; Henze y Martin, 2003; Conratt, 2006; Ettema, 2016; Wang y Youle, 2016; Barshad et al., 2018b).,
activación NF-kB
las subunidades del factor nuclear kappa B, que comprenden el complejo NF-kB, se expresan tanto en las neuronas como en la glía. El complejo NF-kB existe en un estado inactivo en el citoplasma(Ghosh et al., 1998; Aggarwal et al., 2004; Hayden y Ghosh, 2004) donde la activación de NF-kB ha sido bien descrita (Li y Karin, 2000; Baud y Jacque, 2008; Israel, 2010). Cuando es estimulado por moléculas como el TNFa u otros estresores celulares, el TNFa se une a los receptores del TNF (Figura 1)., Esta unión, a través de varios pasos intermedios, conduce a una interacción con el complejo IKB quinasa (IKK), que luego conduce a la fosforilación de IkB, y posteriormente da lugar a la ubiquitinación y degradación de IkB. Una vez degradado, el dímero NF-kB restante (por ejemplo, subunidades p65/p50) se trasloca al núcleo, donde se une a la secuencia de consenso de ADN de varios genes diana. La selectividad de la respuesta NF-kB se basa en varios factores (Sen y Smale, 2010), incluida la composición de los dímeros, el tiempo y el tipo de célula., La influencia de NF-kB en la supervivencia celular también es compleja y puede ser neuroprotectora o proinflamatoria, dependiendo del tipo celular, la etapa de desarrollo y el estado patológico (Qin et al., 2007).
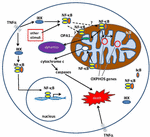
la Figura 1. Vías para la señalización del factor nuclear κ b (NF-kB) en el citoplasma y la mitocondria. El complejo NF-kB tri-subunt (por ejemplo, P65, P50, IkB – una posible combinación) existe en un estado inactivo en el citoplasma. La activación de NF-kB se inicia cuando moléculas como el TNFa se unen a los receptores del TNF (existen diferentes tipos)., Otros estímulos externos o internos también pueden activar NF-kB. Un complicado proceso de transducción de señales comienza una vez que se activan los receptores TNF; la cinasa IkB (IKK) se activa en última instancia y conduce a la fosforilación de IkB, lo que resulta en la ubiquitinación y degradación de IkB. Una vez que IkB se degrada, el dímero NF-kB restante (por ejemplo, P65/P50 o combinaciones de subunidades p50/p50 son posibles) se trasloca al núcleo, donde se une a una secuencia de consenso de ADN de genes diana., Por procesos no bien entendidos, el complejo NF-kB o subunidades NF-kB también pueden migrar a la mitocondria, donde la evidencia sugiere que ocupan el espacio intermembrana. Una vez dentro de las mitocondrias, se cree que NF-kB interactúa con los genes OXFOS (ADNmt mitocondrial) que conduce a la expresión de proteínas involucradas en varias funciones, incluyendo la dinámica mitocondrial y la regulación de COX III (componente del complejo IV)., La evidencia también sugiere que el NF-kB puede funcionar como un interruptor en las mitocondrias y controlar el equilibrio entre la utilización de la glucólisis citoplasmática y la respiración mitocondrial en las células normales y en el cáncer. Finalmente, los datos también apuntan a la estimulación intrínseca de la vía apoptótica, donde la activación de NF-kB en las mitocondrias conduce a la liberación del citocromo c, desencadenando así cascadas de caspasa y muerte celular programada.,
organizativamente, NF-kB es un factor de transcripción de la familia Rel y está asociado con cinco genes, NF-kB1, NF-kB2, RELA, RELB y REL (Chen y Greene, 2004); estos genes codifican varias proteínas, NF-kB1, NF-kB2, RelA, RelB y c-Rel, respectivamente, donde dos de las proteínas son grandes proteínas precursoras conocidas como P105 y P100 que se someten a proteólisis para convertirse en P50 Y P52, respectivamente. Estas proteínas contienen dominios REL-homología (RHD) en su región amino-terminal; la región RHD se compone de 2 dominios separados, pero contiguos., La secuencia más distante de la región carboxi-terminal permite que la proteína se una al ADN. Una secuencia más interior permite que las proteínas de la familia Rel dimericen (homo-o heterodímeros) para la supresión de la expresión a través de la Unión de su correspondiente familia de inhibidores, las proteínas IkB (Chen y Greene, 2004). La última secuencia incluye la secuencia de localización nuclear (NLS) que se desenmascara cuando IkB se desata por degradación. El NLS tiene el trabajo de guiar o etiquetar proteínas activas para su importación al núcleo celular (Chen y Greene, 2004; Karin et al., 2004; Barger et al.,, 2005).
tres de estas proteínas (RelA, RelB y c-REL) también codifican un dominio de transactivación (TADs) en su región carboxi-terminal. Los TADs permiten que estas proteínas interactúen con el aparato de transcripción basal, conocido como la proteína de unión TATA (TBP), el Factor de transcripción IIB, así como los coactivadores transcripcionales de la proteína de unión P300 y del elemento de respuesta cAMP (CREB) (CBP) (Chen y Greene, 2004)., Solo estas tres proteínas son capaces de inducir la transcripción de sus regiones codificantes de ADN, mientras que las otras proteínas, los homodímeros p50 Y P52, son capaces de ocupar los sitios de unión del ADN sin iniciar la transcripción. Dado esto, las proteínas de los 2 homodímeros posteriores de p50 Y p52 actúan como represores transcripcionales (Chen y Greene, 2004).
los homodímeros p105 y p100 ocupan sitios de unión de ADN bloqueando así la transcripción a través de factores de transcripción que sí poseen TADs (Barger et al., 2005). Una tercera forma de represión transcripcional se debe a las proteínas IkB., Estas proteínas tienen varias repeticiones de anquirina como su dominio Central y su función al unirse a la RHD que enmascara la NLS (Karin et al., 2004). Sin un NLS activo, las proteínas NF-kB están restringidas al citoplasma y son incapaces de migrar hacia el núcleo, por lo que la transcripción se bloquea.
NF-kB se encuentra en las mitocondrias
en 2001, un estudio de Bottero et al. (2001) encontraron IkBa y la subunidad NF-kB p65 en fracciones subcelulares y mitocondrias purificadas de células Jurkat. Las células Jurkat son una línea celular inmortalizada de células de linfocitos T humanos que se utilizan para estudiar la leucemia., En el estudio de Bottero, se determinó que IkBa y NF-kB p65 estaban localizados en el espacio intermembrana mitocondrial. El espacio intermembrana mitocondrial es el espacio que existe entre la membrana mitocondrial interna (IMM) y la membrana mitocondrial externa (OMM).
posteriormente, Cogswell et al. (2003) también mostraron que las subunidades NF-kB, p50 y P65, e IkBa, se encontraron en las mitocondrias. Para determinar esto, se utilizaron varios métodos para proporcionar evidencia, incluida la microscopía electrónica de secciones de células U937., Las células U937 se aislaron primero del linfoma de un paciente masculino de mediana edad para estudiar el comportamiento y la diferenciación de los monocitos. Aquí Cogswell et al. (2003) fue capaz de visualizar las subunidades NF-kB p50 y P65 y IkBa en la matriz interna de las mitocondrias. En este estudio también se examinaron las células hepáticas de rata y también se identificaron la subunidad P50 y la subunidad IkBa. Además, las células U937 fueron estimuladas durante 1 h con TNFa, un desencadenante conocido de la vía de señalización NF-kB., En este experimento, los análisis de Western blot en fracciones mitocondriales y citoplasmáticas encontraron que el tratamiento con TNFa causó una pérdida de IkBa en los compartimentos mitocondrial y citoplasmático por 30 minutos después del tratamiento, lo que sugiere que IkBa se degradó. El análisis EMSA, un ensayo in vitro que detecta la activación de NF-kB y la Unión inespecífica a secuencias de ADN, también se llevó a cabo en proteínas tomadas de extractos nucleares de mitocondrias aisladas de células u937 estimuladas con TNFa., Aquí determinaron que la señalización de TNFa condujo a una mayor actividad de unión al ADN de NF-kB p50, en proteínas tomadas de las mitocondrias.
otros estudios también han detectado NF-kB en las mitocondrias. Estos incluyen estudios (Guseva et al., 2004; Zamora et al., 2004) en líneas celulares HT1080 de fibroblastos humanos, líneas celulares LNCaP y PC3 de próstata humana, y células HeLa. En las células LNCaP, las subunidades mitocondriales NF-kB P50 y P65 se encontraron unidas al ADN mitocondrial (ADNmt)., Tomados en conjunto, estos estudios muestran evidencia para la señalización de NF-kB en las mitocondrias y que NF-kB regula la expresión de ARNm mitocondrial(ver NF-kB y la sección de expresión génica mitocondrial a continuación).
NF-kB controla la dinámica mitocondrial
hay varias proteínas implicadas en la dinámica (fisión y fusión) y morfología de las mitocondrias (Karbowski y Youle, 2003; Olichon et al., 2006; Brooks y Dong, 2007; Song et al., 2008; Autret y Martin, 2010; Silva et al., 2013; Sinha y Manoj, 2019). Una de ellas es la proteína atrofia óptica 1 (OPA1) (Olichon et al.,, 2006; Garcia et al., 2018; Lee y Yoon, 2018). Los estudios han sugerido que OPA1 es un regulador de la fusión de la membrana interna mitocondrial y también la remodelación de las cristas mitocondriales (Cipolat et al., 2006). Recientemente Laforge et al. (2016) mostraron que la ausencia de IKKa tuvo un impacto en la expresión de OPA1 en las mitocondrias y en la morfología mitocondrial.
sorprendentemente, en un estudio reciente de Nan et al. (2017), se encontró que la estimulación del receptor 2 de TNFa (TNFR2) promueve la fusión mitocondrial a través de la activación dependiente de NF-kB de la expresión de OPA1 en miocitos cardíacos., Es importante destacar que la activación del TNFR2 en este estudio protegió a los miocitos cardíacos contra el estrés mediante la regulación al alza de la expresión de OPA1. La administración de bajas concentraciones de TNFa exógeno (0,5 ng/mL) antes de la isquemia-reperfusión pareció mejorar la supervivencia celular, mientras que las concentraciones más altas (10-20 ng/mL) provocaron efectos tóxicos en las células.
NF-kB y Apoptosis en las mitocondrias
El papel de las mitocondrias en la muerte celular programada, o apoptosis, se conoce desde hace bastante tiempo (Green y Reed, 1998; Wang Y Chen, 2015)., El papel más importante para las mitocondrias es la generación de ATP; sin embargo, la segunda función más importante para las mitocondrias es probablemente en el control de la muerte celular. ¿Cómo hace esto la mitocondria? Si la mitocondria falla en desencadenar la muerte celular, el cáncer es a menudo la consecuencia. Por lo tanto, para regular la muerte celular, las mitocondrias integran señales de una variedad de fuentes, que se conocen como vías intrínsecas de apoptosis. Los componentes de la actividad de NF-kB parecen ser una de estas señales, aunque el TNFa, un activador de NF-kB, es parte de una vía extrínseca de apoptosis., Las vías extrínsecas (mediadas por receptores de muerte) se inician fuera de la célula, mientras que las vías intrínsecas de apoptosis están mediadas y activadas en las mitocondrias.
en un estudio reciente de Pazarentzos et al. (2014), se encontró que IkBa ejerce actividad pro-apoptótica ya que inhibe el anti-apoptótico NF-kB. En la mayoría de las células, la activación de NF-kB conduce a la expresión del gen diana aguas abajo que desencadena la resistencia a la muerte celular(Luo et al., 2005). En este estudio, se demostró que una nueva función de apoptosis se debía a IkBa, la subunidad que inhibe la activación de NF-kB. Pazarentzos et al., (2014) encontraron que IkBa se localiza en el OMM donde interactúa con un canal de aniones dependiente de voltaje (VDAC) y la hexoquinasa mitocondrial II (HKII) para estabilizar este complejo y prevenir la liberación de citocromo C mediada por Bax para la apoptosis. Bax es un miembro de la familia de proteínas Bcl – 2, que han demostrado ser reguladores de la muerte celular programada (Karbowski et al., 2006).
otros estudios también han insinuado el papel de NF-kB en la regulación más directa de la apoptosis en la mitocondria. En un estudio de Liu et al., (2004), la inhibición de NF-kB solo en macrófagos resultó en la liberación de citocromo C. recordemos que el citocromo c es responsable de trasladar electrones del complejo III al complejo IV y que la liberación de citocromo c En el citoplasma, un activador de caspasas, es un paso clave en la activación de la apoptosis.
en muchos estudios se ha demostrado que el NF-kB y la respiración mitocondrial
el factor nuclear kappa B promueve la tumorogénesis. Cómo esto ocurre no estaba exactamente claro. En un estudio innovador de Mauro et al., (2011), se encontró que NF-kB regulaba al alza la respiración mitocondrial en células de carcinoma de colon. Aquí establecieron que esta función de NF-kB suprime el efecto Warburg. Recordemos que el efecto Warburg (Vander Heiden et al., 2009) describe la observación de que las células cancerosas tienden a favorecer el metabolismo por glucólisis en lugar de por la vía de fosforilación oxidativa más eficiente. Por lo tanto, en este estudio los autores determinaron que NF-kB organiza redes de metabolismo energético mediante el control del equilibrio entre la utilización de la glucólisis y la respiración mitocondrial., Curiosamente, encontraron un papel para el NF-kB en la adaptación metabólica en células normales y en cáncer. Sus resultados sugirieron además que la supresión del metabolismo mitocondrial en células cancerosas establecidas mediante la inhibición de NF-kB y metformina disminuye la tumorigenesis.
NF-kB y expresión génica mitocondrial
el factor nuclear kappa B es un regulador conocido de la expresión génica, tanto negativa como positivamente (Mattson et al., 2000). Sin embargo, cómo NF-kB regula o influye en la expresión génica mitocondrial codificada nuclear es menos entendida., El ADNmt humano posee 37 genes que codifican para 13 polipéptidos. Se ha demostrado que los genes del ADNmt codifican para muchas de las subunidades de los 5 complejos de la cadena de transporte de electrones (ETC), 2 ARNr y 22 ARNt. No obstante, la mayoría de las subunidades ETC están codificadas por ADN nuclear, que podría estar influenciado por la actividad de NF-kB (Calvo et al., 2016).
por ejemplo, se ha afirmado (Cogswell et al., 2003) que la vía NF-kB puede regular negativamente la expresión génica mitocondrial asociada con la subunidad COX III., La subunidad COX III está codificada por el ADNmt y es un componente del complejo IV en la mitocondrial, etc. Funciona como una subunidad catalítica en el complejo IV, que es el complejo asociado con el consumo de oxígeno mitocondrial. En un estudio realizado por Cogswell et al. (2003), la modulación de la activación de NF-kB resultó en la pérdida de expresión tanto de COX III como del ARNm del citocromo B. Otros estudios apoyan el papel de la NF-kB en la regulación de genes mitocondriales adicionales, como COX I y Cytb (Psarra y Sekeris, 2008, 2009; Barshad et al., 2018b)., Además, la subunidad p65 de NF-kB redujo los niveles de ARNm CITB codificado en mtDNA, posiblemente al unirse al bucle D en células humanas en ausencia de p53 (Johnson et al., 2011). En general, estos resultados sugieren que la señalización NF-kB puede influir en la actividad enzimática de los complejos etc respiratorios.
NF-kB Media la disfunción inducida por Aß en las mitocondrias
la enfermedad de Alzheimer (EA) se asocia con la acumulación de placas de Aß y / o la aparición de enredos neurofibrilares (PFN) en ciertas regiones cerebrales (Duyckaerts et al., 2009)., Sin embargo, existe controversia en torno a si el Aß es un agente causal de la EA o si el Aß está simplemente correlacionado con el envejecimiento. Acumulación de pruebas (Aliev et al., 2009; Correia et al., 2012; Cadonic et al., 2016; Cardoso et al., 2017; Djordjevic et al., 2017) también ahora señala los cambios en el metabolismo cerebral impulsados por la disfunción mitocondrial como un proceso central para muchos trastornos neurodegenerativos relacionados con la edad, incluida la EA. Además de esta evidencia, también hay alteraciones en la actividad enzimática de los complejos proteicos del ETC y alteraciones en la actividad enzimática antioxidante (Kolosova et al.,, 2017) en AD. En particular, se ha demostrado que la actividad IV compleja se ve afectada negativamente en la EA (Mutisya et al., 1994).
en un estudio reciente de Shi et al. (2014), se encontró que Aß deterioró la función mitocondrial a través de la señalización NF-kB. Además, Shi et al. (2014) mostraron aquí que Aß disminuyó la expresión de la subunidad COX III a través de una vía NF-kB., Es importante destacar que para eliminar la posibilidad de que IkBa fuera fosforilada por Aß en el citoplasma (y luego transportada a las mitocondrias), las mitocondrias aisladas fueron incubadas con Aß en presencia (o ausencia) de un bloqueador de NF-kB, concretamente BAY11-7082. Aquí encontraron fosforilación inducida por Aß y degradación de IkBa en mitocondrias aisladas.
estos hallazgos también tienen implicaciones importantes para el tratamiento de la EA, como lo demuestran estudios recientes de Snow et al. (2018) y como se muestra en otros estudios relacionados (Djordjevic et al., 2017; Adlimoghaddam et al.,, 2019) que sugieren que la señalización dirigida a NF-kB en las mitocondrias puede tener valor terapéutico. Por ejemplo, en Snow et al.’s estudio, creatina-un modulador conocido de la función mitocondrial (Tarnopolsky y Beal, 2001), se mostró para aumentar y alterar positivamente los niveles de proteínas de CaMKII, PSD-95, y Complejo 1 subunidades en ratones alimentados con creatina, mientras que la NF-kB inhibitoria subunidad IkB se redujo. Para una lectura adicional sobre el potencial efecto terapéutico de la creatina en la función mitocondrial y en los trastornos mitocondriales u otros trastornos neurológicos, ver estudios y revisiones de Matthews et al., (1998), Klivenyi et al. (1999), Tarnopolsky y Beal (2001), Hersch et al. (2006), Rodriguez et al. (2007) y Beal (2011).
El papel de NF-kB en la inflamación y el metabolismo mitocondrial
datos crecientes (Lamas et al., 2003; Mauro et al., 2011; Moretti et al., 2012) sugieren que la señalización NF-kB, que es un mediador de los procesos inflamatorios, también está funcionando como un regulador e integrador con el metabolismo energético. En un estudio reciente de Zhong et al. (2016), se demostró que NF-kB restringía la activación del inflamasoma a través de la eliminación de las mitocondrias dañadas., Sorprendentemente, NF-kB parecía tanto cebar el inflamasoma NLRP-3 para la activación y también previno la inflamación excesiva y la activación del inflamasoma nlrp-3 restringido; aunque el mecanismo de restricción estaba mal definido. Aquí se especuló que además de ser NF-kB un activador de genes inflamatorios, también funcionó en este estudio limitando la activación del inflamasoma NLRP3 y la producción de IL-1β. Además, se encontró que la inducción de p62 era responsable de la actividad inhibitoria del inflamasoma por NF-kB., Parece que NF-kB puede contener su propia inflamación en macrófagos promoviendo la eliminación mediada por p62 de las mitocondrias dañadas (mitofagia) después de que los macrófagos interactúan con diferentes activadores del inflamasoma NLRP3.
conclusión
hace más de 10 años, se detectó NF-kB en las mitocondrias. Sorprendentemente, para un factor de transcripción tan importante, poco progreso se ha hecho en el descubrimiento de roles específicos para NF-kB que afectan a la mitocondria., Algunos estudios, como se describió anteriormente, proporcionan evidencia de NF-kB en la dinámica mitocondrial, la apoptosis, el control respiratorio, la expresión génica y los mecanismos de la enfermedad (Figura 1). Sin embargo, la duplicación de estos resultados y la validación general siguen siendo necesarias por parte de otros laboratorios. Se puede obtener información adicional del hecho de que otros factores de transcripción que tienen efectos en los genes nucleares, como AP-1, p53, CREB, c-Myc, Wnt13, Dok-4, HMGA1 y c-Src también se han detectado en las mitocondrias (Psarra y Sekeris, 2008)., Curiosamente, se han determinado los sitios de unión en el genoma mitocondrial (homólogos a sus sitios de unión en el ADN nuclear) para algunos de estos factores (Psarra y Sekeris, 2008) donde se sospechan los roles de la transcripción mitocondrial y la apoptosis y muestran algunos patrones generales de actividad. Por ejemplo, se puede argumentar que algunos de estos factores (NF-kB, CREB y AP-1) se unen a los genomas mitocondriales y en su mayoría atenúan la expresión génica mitocondrial (Blumberg et al., 2014), mientras que tiene efectos estimulantes sobre la transcripción de genes nucleares., Sin embargo, es evidente que se necesita más trabajo no sólo para encontrar funciones precisas de actividad, sino también para determinar si realmente existen pautas generales de actividad.
después de examinar esta literatura, también se hace evidente que el papel de NF-kB en la regulación de la respiración mitocondrial tiene profundas implicaciones y demuestra un nivel de complejidad no apreciado anteriormente. Por ejemplo, Mauro et al. (2011) los datos establecen un papel del NF-kB en la adaptación metabólica en células normales y en cáncer, y también sugieren consecuencias para otros estados de la enfermedad como la EA., Además, dado que el NF-kB puede contener su propia inflamación, como muestra Zhong et al. (2016), no solo es sorprendente, sino que ejemplifica aún más la complejidad de la señalización de NF-kB en la función mitocondrial.
en esta revisión, se encuestaron estudios sobre el papel de NF-kB en la función mitocondrial, y parece que la investigación en esta área está aumentando. Complicando los resultados, sin embargo, es la observación de que múltiples factores están jugando papeles similares en la función mitocondrial y por lo que los estudios detallados específicos de cada factor son necesarios., En conclusión, podemos volver a hacer la pregunta – ¿qué está haciendo NF-kB en y para la mitocondria? La respuesta inmediata y abreviada sería-mucho!
Aportes del Autor
El autor creó el tema y escribió el manuscrito.
financiación
Este trabajo fue apoyado por fondos de los Institutos Canadienses de Investigación de la salud (CIHR), Canadian Agricultural Partnership (CAP), St.Boniface Hospital Research Foundation, Alzheimer Society of Manitoba, Research Manitoba, The Honourable Douglas and Patricia Everett, y Royal Canadian Properties Limited Endowment Fund.,
Declaración de conflicto de intereses
El autor declara que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran ser interpretadas como un potencial conflicto de intereses.
agradecimientos
El autor desea agradecer al Dr. Grant Hatch la revisión del manuscrito.
Hayden, M. S., and Ghosh, S. (2004). Señalización A NF-kappaB. Genes Dev. 18, 2195–2224.
PubMed Abstract | Google Scholar
Wang, X. and Chen, X. J. (2015)., Una red citosólica que suprime el estrés proteostático mediado por mitocondrias y la muerte celular. Nature 524, 481-484. doi: 10.1038 / nature14859
PubMed Abstract | CrossRef Full Text | Google Scholar