la teoría de ácidos y Bases de Brønsted-Lowry
la teoría de ácidos y bases de Brønsted-Lowry llevó la definición de Arrhenius un paso más allá, ya que una sustancia ya no necesitaba estar compuesta de iones de hidrógeno (H+) o hidróxido (OH-) para ser clasificada como ácido o base. Para exmapl, considere la siguiente ecuación química:
\
- Un ácido Brønsted-Lowry es un donante de protones (iones de hidrógeno).
- Una base de Brønsted-Lowry es un aceptor de protones (iones de hidrógeno).,
En esta teoría, un ácido es una sustancia que puede liberar un protón (como en la teoría de Arrhenius) y una base es una sustancia que puede aceptar un protón., Una sal básica, como Na+F-, genera iones OH – en el agua tomando protones del agua misma (para hacer HF):
\
- disociación ácida
\
- constante de ionización ácida:
\}{}\]
- disociación Base:
- constante de ionización de la base
\} {}\]
la determinación de una sustancia como ácido o base de Brønsted-Lowery solo se puede hacer observando la reacción. En el caso del HOH es una base en el primer caso y un ácido en el segundo caso.,
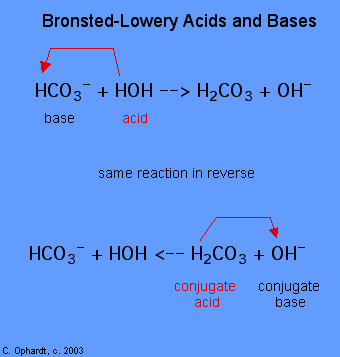
para determinar si una sustancia es un ácido o una base, cuente los hidrógenos en cada sustancia antes y después de la reacción. Si el número de hidrógenos ha disminuido esa sustancia es el ácido (Dona iones de hidrógeno). Si el número de hidrógenos ha aumentado esa sustancia es la base (Acepta iones de hidrógeno). Estas definiciones se aplican normalmente a los reactivos de la izquierda. Si la reacción se ve en sentido inverso, se pueden identificar nuevos ácidos y bases., Las sustancias en el lado derecho de la ecuación se llaman ácido conjugado y base conjugada en comparación con las de la izquierda. También tenga en cuenta que el ácido original se convierte en la base conjugada después de que la reacción haya terminado.
Nota
Los ácidos son donantes de protones y las Bases son aceptores de protones
para que una reacción esté en equilibrio, debe ocurrir una transferencia de electrones. El ácido dará un electrón y la base recibirá el electrón. Los ácidos y Bases que trabajan juntos de esta manera se llaman un par conjugado compuesto por ácidos conjugados y bases conjugadas.,
\
a significa un compuesto ácido y Z significa un compuesto básico
- A dona H para formar HZ+.
- Z acepta H de a que forma HZ +
- A-se convierte en base conjugada de HA y en la reacción inversa acepta una H de HZ para recrear HA con el fin de permanecer en equilibrio
- HZ+ se convierte en un ácido conjugado de Z y en la reacción inversa dona una H A A – recreando Z con el fin de permanecer en equilibrio