The 1913 Bohr model of the hydrogen atom was replaced by Schrodingerʹs wave mechanical model in 1926. Sin embargo, el modelo Bohrʹs todavía se enseña de manera rentable hoy en día debido a su simplicidad conceptual y matemática, y porque introdujo una serie de ideas clave de la mecánica cuántica, como el número cuántico, la cuantización de propiedades observables, el salto cuántico y el estado estacionario.,
Bohr calculó la variedad de energías electrónicas permitidas equilibrando las fuerzas mecánicas (centrípeta y electron‐núcleo) en un electrón ejecutando una órbita circular de radio R alrededor del núcleo, y luego cuantificando arbitrariamente su Momento angular. Finalmente por fiat declaró que el electrón estaba en un estado estacionario no radiante porque una carga en órbita (aceleración) irradia energía y colapsará en el núcleo de carga opuesta.,
en 1924 De Broglie postuló la dualidad onda‐partícula para el electrón y otras partículas masivas, proporcionando así la oportunidad de eliminar parte de la arbitrariedad del modelo de Bohrʹs. Por ejemplo, un electrón que posee propiedades de onda está sujeto a interferencias constructivas y destructivas. Como se mostrará, esto conduce naturalmente a la cuantización del momento del electrón y la energía cinética, y consecuentemente a una variedad de estados de energía permitidos para el electrón en relación con el núcleo., El modelo de Broglie-Bohr del átomo de hidrógeno presentado aquí trata al electrón como una partícula en un anillo con propiedades ondulatorias.
\
la hipótesis de Broglie de que la materia tiene propiedades ondulatorias.
\
la consecuencia de la hipótesis de Broglieʹs; un número integral de longitudes de onda debe caber dentro de la circunferencia de la órbita. Esto introduce el número cuántico que puede tener valores 1,2,3,… El estado de electrones n = 4 se muestra a continuación.,
\
la Sustitución de la primera ecuación en la segunda ecuación revela que el impulso está cuantificada.
\
si el momento está cuantizado, también lo está la energía cinética.
\
lo que significa que la energía total está cuantizada. El segundo término es la energía potencial electrostática electrón‐protón.
la interpretación mecánica cuántica de estos orbits ʺBohr is es que son estados estacionarios. A pesar de que usamos la expresión energía cinética, que implica movimiento de electrones, no hay movimiento., El electrón ocupa la órbita como una onda de partícula, no está orbitando el núcleo. Si estuviera orbitando en un sentido clásico, irradiaría energía y colapsaría rápidamente en el núcleo. Es evidente que la estabilidad de la materia requiere la versión mecánica cuántica de la energía cinética.
la energía del estado fundamental y el radio orbital del electrón en el átomo de hidrógeno se encuentran trazando la energía como una función del radio orbital. El estado fundamental es el mínimo en la curva de energía total., Naturalmente, el cálculo se puede utilizar para obtener la misma información al minimizar la energía con respecto al radio de la órbita. Sin embargo, el método gráfico tiene la virtud de iluminar el tema de la estabilidad atómica.
constantes fundamentales: carga de electrones, masa de electrones, constante de Planck, permitividad al vacío.
número cuántico y hecho de conversión entre metros y picómetros y julios y attojulios.
\
\
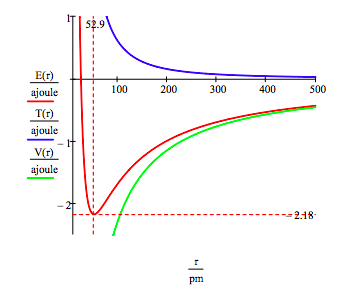
Esta figura muestra que la estabilidad atómica implica un equilibrio entre la energía potencial y la cinética., El electrón es atraído hacia el núcleo por la interacción de energía potencial atractiva (~ -1/R), pero se le impide colapsar en el núcleo por la energía cinética extremadamente grande (~1/R2) asociada con órbitas pequeñas.
como se muestra a continuación, el enfoque gráfico también se puede utilizar para encontrar los estados excitados electrónicos.
\
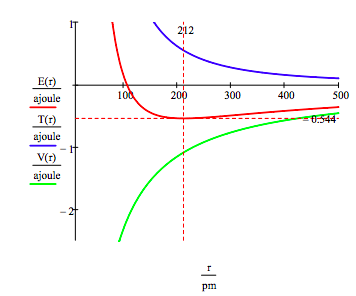
como se mencionó anteriormente, la variedad de energías electrónicas permitidas también se puede obtener minimizando la energía con respecto al radio de la órbita. Este procedimiento produce,