la relación entre la presión y el volumen: la Ley de Boyle
a medida que la presión sobre un gas aumenta, el volumen del gas disminuye porque las partículas de gas se ven forzadas a acercarse. Por el contrario, a medida que la presión sobre un gas disminuye, el volumen de gas aumenta porque las partículas de gas ahora se pueden separar más., Los globos meteorológicos se hacen más grandes a medida que se elevan a través de la atmósfera a regiones de menor presión debido a que el volumen del gas ha aumentado; es decir, el gas atmosférico ejerce menos presión sobre la superficie del Globo, por lo que el gas interior se expande hasta que las presiones internas y externas son iguales.
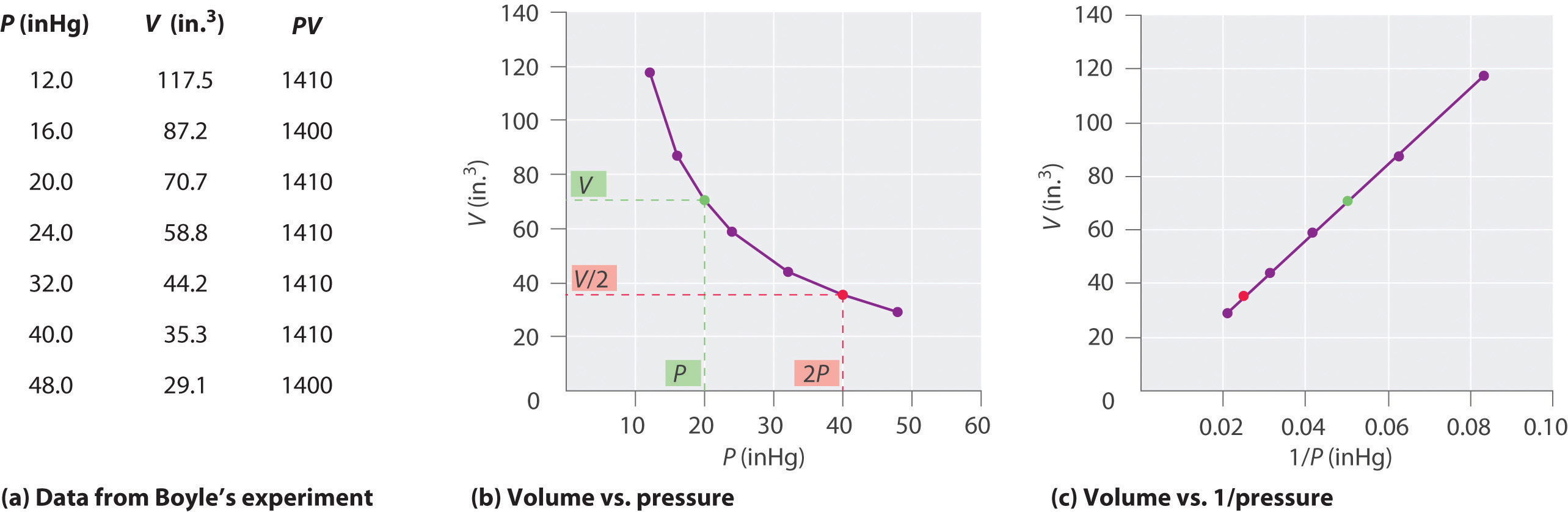
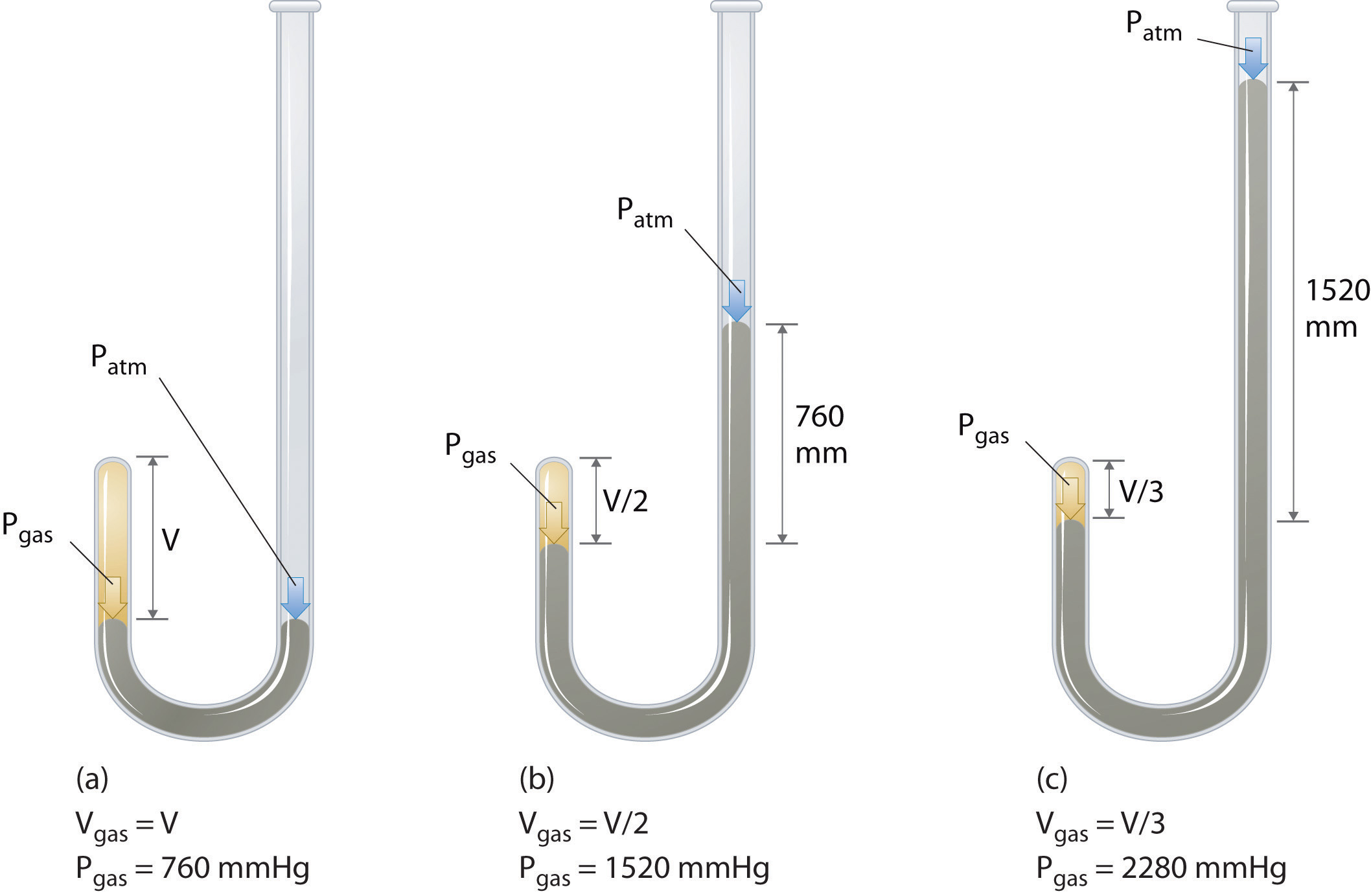
El químico irlandés Robert Boyle (1627-1691) llevó a cabo algunos de los primeros experimentos que determinaron la relación cuantitativa entre la presión y el volumen de un gas. Boyle usó un tubo en forma de J parcialmente lleno de mercurio, como se muestra en la figura \(\PageIndex{1}\)., En estos experimentos, una pequeña cantidad de gas o aire queda atrapada por encima de la columna de mercurio, y su volumen se mide a presión atmosférica y temperatura constante. Luego se vierte más mercurio en el brazo abierto para aumentar la presión sobre la muestra de gas. La presión sobre el gas es la presión atmosférica más la diferencia en las alturas de las columnas de mercurio, y se mide el volumen resultante. Este proceso se repite hasta que no haya más espacio en el brazo abierto o el volumen del gas sea demasiado pequeño para ser medido con precisión., Datos como los de uno de los experimentos de Boyle pueden ser trazados de varias maneras (figura \(\PageIndex{2}\)). Una gráfica simple de \(V\) versus\ (P\) da una curva llamada hipérbola y revela una relación inversa entre presión y volumen: a medida que la presión se duplica, el volumen disminuye por un factor de dos. Esta relación entre las dos cantidades se describe de la siguiente manera:
\
Dividir ambos lados por \(P\) le da una ecuación que ilustra la relación inversa entre \(P\) y \(V\):
\
o
\
donde ∝ símbolo se lee «es proporcional.»Una gráfica de V versus 1 / P es por lo tanto una línea recta cuya pendiente es igual a la constante en la ecuación 6.2.1 y la ecuación 6.2.3. Dividir ambos lados de la ecuación 6.2.1 por V en lugar de P da una relación similar entre P y 1 / V., El valor numérico de la constante depende de la cantidad de gas utilizada en el experimento y de la temperatura a la que se llevan a cabo los experimentos. Esta relación entre la presión y el volumen se conoce como la Ley de Boyle, por su descubridor, y se puede afirmar de la siguiente manera: a temperatura constante, el volumen de una cantidad fija de un gas es inversamente proporcional a su presión.