Introducción
Los electrones no tienen una posición fija en átomos, compuestos y moléculas (Ver imagen abajo) pero tienen probabilidades de ser encontrados en ciertos espacios (orbitales). Las formas de resonancia ilustran áreas de mayores probabilidades (densidades de electrones). Esto es como sostener el sombrero en la mano derecha o en la izquierda. El término Resonancia se aplica cuando hay dos o más posibilidades disponibles., Los químicos usan diagramas de Lewis para representar la estructura y la Unión de entidades covalentes, como moléculas e iones poliatómicos, en adelante, moléculas. El diagrama de Lewis de muchas moléculas, sin embargo, no es consistente con las propiedades observadas de la molécula.
Ejemplo \(\PageIndex{1}\): Ion Nitrato
el ion nitrato, según su diagrama de Lewis, tiene dos tipos de enlaces nitrógeno-oxígeno, un enlace doble y dos enlaces simples, lo que sugiere que un enlace nitrógeno-oxígeno en el ion nitrato es más corto y más fuerte que cada uno de los otros dos., Además, la estructura de Lewis implica, con respecto a la carga formal, que hay dos tipos de átomos de oxígeno en el ion nitrato, uno formalmente neutral y cada uno de los otros dos con una carga formal de -1. Experimentalmente, sin embargo, los tres enlaces nitrógeno-oxígeno en el ion nitrato tienen la misma longitud de enlace y la misma energía de enlace, y los tres átomos de oxígeno son indistinguibles. El diagrama de Lewis no explica la estructura y la Unión del ion nitrato satisfactoriamente.
Se pueden dibujar dos diagramas adicionales de Lewis para el ion nitrato.,
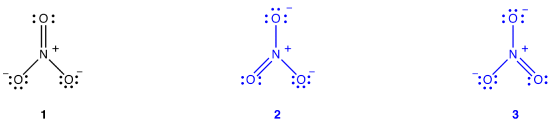
Sin embargo, ninguno de ellos es consistente con las propiedades observadas del ion nitrato y, por lo tanto, no representa correctamente el ion nitrato.
Ejemplo \(\PageIndex{2}\): benceno
El benceno, según su diagrama de Lewis, tiene dos tipos de enlaces carbono-carbono, tres enlaces dobles y tres enlaces simples, lo que sugiere que cada uno de los tres enlaces carbono-carbono en el benceno es más corto y más fuerte que cada uno de los otros tres. Experimentalmente, sin embargo, los seis enlaces carbono-carbono en el benceno tienen la misma longitud de enlace y la misma energía de enlace., El diagrama de Lewis no explica la estructura y la Unión del benceno satisfactoriamente.
un atributo de las moléculas de las cuales el diagrama clásico de Lewis no es consistente con las propiedades observadas es que se pueden generar otros diagramas válidos de Lewis para ellas. Se puede dibujar un diagrama de Lewis adicional para el benceno.

Sin embargo, ninguno de ellos es consistente con las propiedades observadas del benceno y, por lo tanto, no representa correctamente el benceno.,
La Teoría de resonancia es un intento de explicar la estructura de una especie, como el ion nitrato o el benceno, cuyo diagrama de Lewis no es consistente con las propiedades observadas de la especie. La principal ventaja de la teoría de la resonancia es que, aunque se basa en un análisis matemático riguroso, la teoría de la resonancia se puede aplicar con éxito invocando poca o ninguna matemática. La teoría de resonancia se explica a continuación utilizando el ion nitrato como ejemplo.
según la teoría de la resonancia, la estructura del ion nitrato no es 1 ni 2 ni 3, sino el promedio de los tres, ponderado por la estabilidad., Los diagramas de Lewis 1, 2 y 3 se llaman formas de resonancia, estructuras de resonancia o contribuyentes de resonancia del ion nitrato. Se dice que la estructura del ion nitrato es un híbrido de resonancia o, simplemente, híbrido de las formas de resonancia 1, 2 y 3. Siempre que es necesario mostrar la estructura del ion nitrato, se dibujan las formas de resonancia 1, 2 y 3, conectadas por flechas de dos cabezas.,
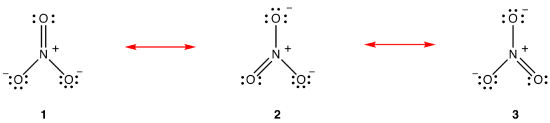
Las tres formas de resonancia del ion nitrato, 1, 2 y 3, son idénticas, por lo que tienen la misma estabilidad y, por lo tanto, contribuyen igualmente al híbrido., Dado que se conoce el grado exacto en el que cada forma de resonancia del ion nitrato contribuye al híbrido, el orden de enlace de cada enlace nitrógeno-oxígeno, así como la carga formal en cada átomo de oxígeno en el híbrido se puede determinar fácilmente:
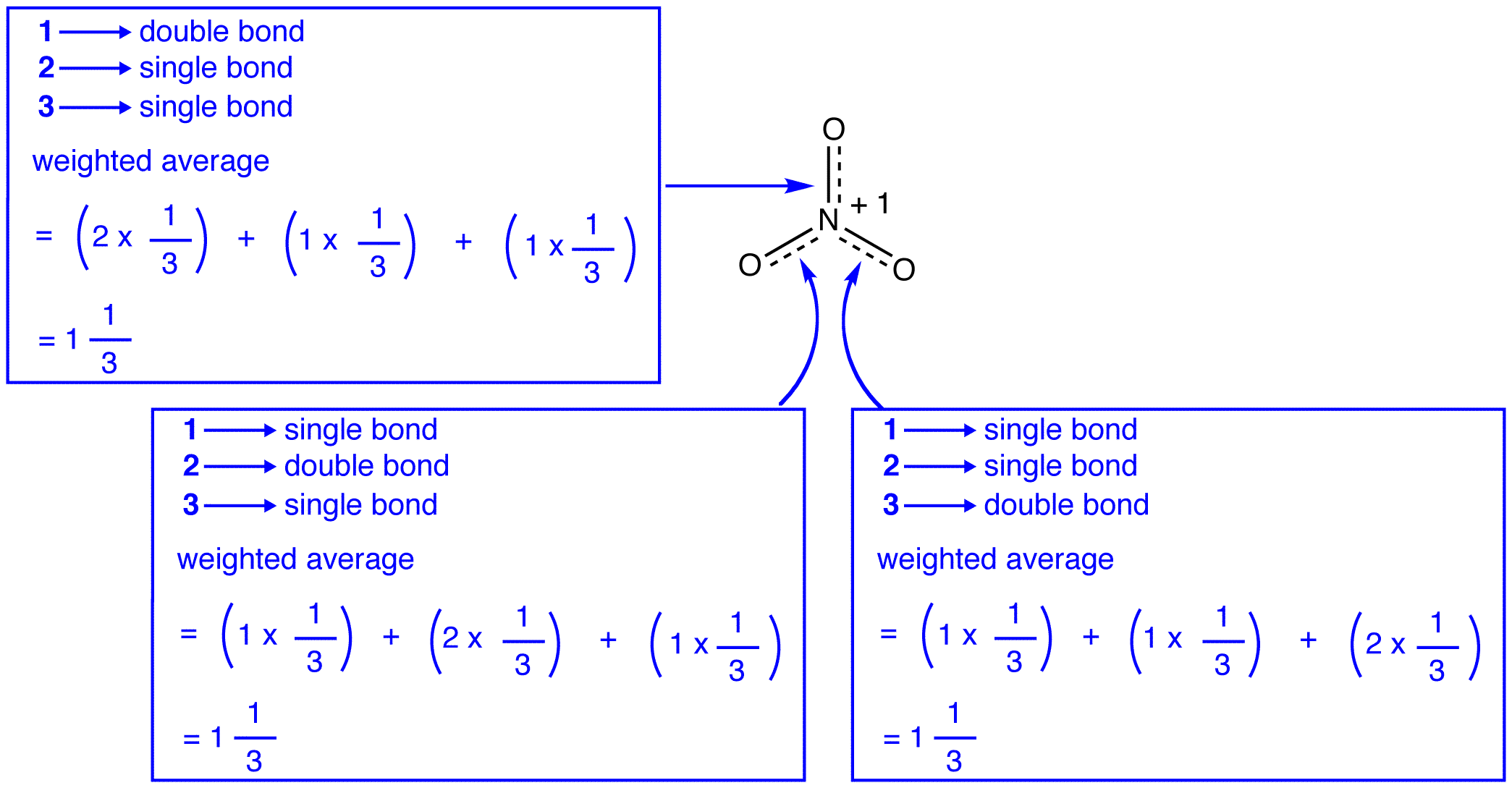
de acuerdo con la teoría de resonancia, cada enlace en el ion nitrato es uno y un tercio de un enlace, lo que es consistente con la observación de que los tres enlaces en el ion nitrato tienen la misma longitud de enlace y misma energía de enlace.,
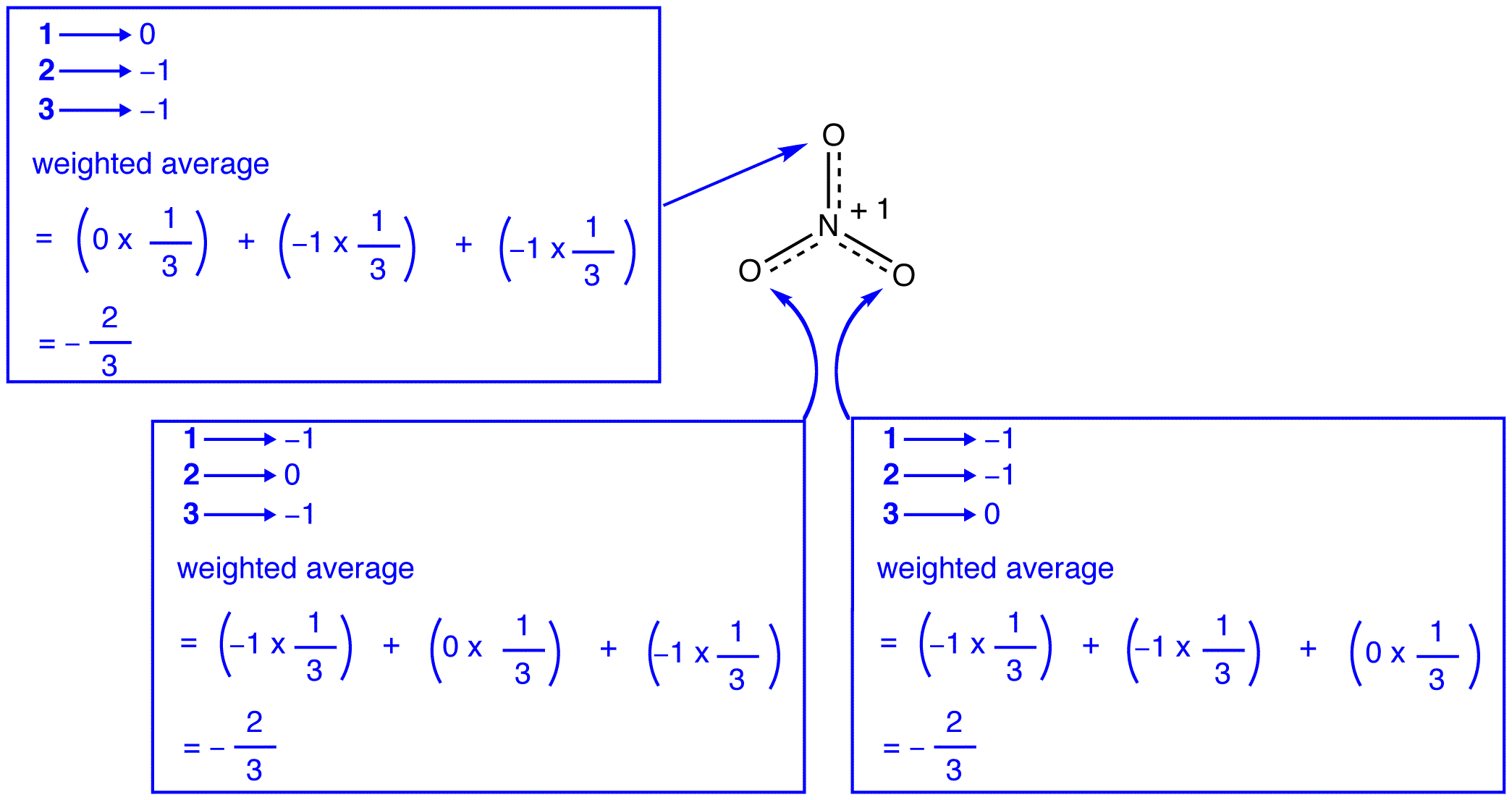
de acuerdo con la teoría de resonancia, cada átomo de oxígeno en el ion nitrato tiene una carga formal de -2/3, que, junto con el hecho de que los tres enlaces nitrógeno-oxígeno son idénticos, es consistente con la observación de que los tres átomos de oxígeno en el ion nitrato son indistinguibles. En cada forma de resonancia del ion nitrato, hay dos electrones \(\pi\), y son compartidos solo por dos átomos. Se dice que un electrón compartido solo por dos átomos está localizado., Por lo tanto, los dos electrones \(\pi\) en cada forma de resonancia del ion nitrato están localizados. El ion nitrato, como el representado por el híbrido, tiene dos \(\pi\) electrones:
- # electrones en un \(\pi\) bono = 2
- # electrones en un tercio de \(\pi\) bono = 2/3
- # electrones en tres de ellos = 3 x (2/3) = 2
Los dos \(\pi\) de los electrones en el ion nitrato, que son compartidos por un total de cuatro átomos, un átomo de nitrógeno y tres átomos de oxígeno. Se dice que un electrón compartido por más de dos átomos está deslocalizado. Por lo tanto, los dos electrones \(\pi\) en el ion nitrato están deslocalizados., La deslocalización de los electrones \(\pi\) en el ion nitrato requiere que los cuatro átomos estén en el mismo plano, permitiendo la superposición lateral de los orbitales p en ellos.,

Si la energía del ion nitrato fueron el promedio ponderado de las energías de sus tres formas de resonancia, así como la estructura del ion nitrato es el promedio ponderado de las estructuras de sus tres resonancia de las formas, debe ser igual a la energía de uno de los tres idénticos resonancia formas:

Si la energía de los híbridos eran iguales a la de una resonancia forma, dado que todas las entidades químicas (partículas elementales, átomos, moléculas, etc.,) naturalmente tienden a estar en el estado de energía más bajo posible, no habría ninguna ventaja para que el ion nitrato exista como el híbrido; simplemente podría existir como una forma de resonancia. Dado que el ion nitrato existe como el híbrido, no como una forma de resonancia, se puede inferir que la energía del híbrido es menor que la de cualquiera de las formas de resonancia.

de acuerdo con la teoría de la resonancia, entonces, la energía de una molécula es menor que la de la forma de resonancia de menor energía., Dado que el ion nitrato tiene menor energía y, por lo tanto, es más estable que cualquiera de sus formas de resonancia, se dice que el ion nitrato está estabilizado por resonancia.
conceptos erróneos comunes
Hay dos conceptos erróneos sobre la teoría de la resonancia entre los estudiantes principiantes, probablemente debido a la interpretación literal de la palabra resonancia. Se describen a continuación, utilizando el ion nitrato como ejemplo.
concepto erróneo 1: El ion nitrato existe como forma de resonancia 1 por un momento y luego cambia a forma de resonancia 2 o a forma de resonancia 3, que se interconvierte o revierte a 1.,

La estructura del ion nitrato no es 1 ni 2 ni 3 sino el híbrido y no cambia con el tiempo a menos que se someten a una reacción.
concepto erróneo 2: en una muestra de iones nitrato, en un momento dado, un tercio de los iones existen como forma de resonancia 1, otro tercio como forma de resonancia 2, y el tercio restante como forma de resonancia 3.

en una muestra de iones nitrato, en un momento dado, todos los iones tienen la misma estructura, que es el híbrido.,
Mules and Rhinoceros
La analogía clásica utilizada para aclarar estos dos conceptos erróneos es la mula (Morrison, R. T.; Boyd, R. N. Organic Chemistry, fifth edition; Allyn and Bacon: Boston, 1987, pg. 373). Biológicamente, una mula es un híbrido de un caballo y un burro. Esto no significa que una mula se asemeje a un caballo por un momento y luego cambie a parecerse a un burro. La aparición de una mula es una combinación de la de un caballo y de un burro y no cambia con el tiempo. Tampoco significa que, en una manada, algunas mulas se asemejan a un caballo y las otras a un burro., En una manada, todas las Mulas tienen la misma apariencia, que es una combinación de un caballo y un burro. La debilidad de esta analogía es que los caballos y los burros existen, mientras que las formas de resonancia son estrictamente hipotéticas. Una analogía mejor, citada en Morrison y Boyd, es el rinoceronte. Al ver un rinoceronte, uno podría describirlo como el híbrido de un dragón y un unicornio, dos criaturas que no existen.