Indledning
Type 2 diabetes mellitus (T2DM) er karakteriseret ved insulinresistens, som er relativt stabil i hele forløbet af sygdommen, og en gradvis tab af β-celle funktion med en utilstrækkelig insulin sekretion., På grund af denne progressive udvikling, de fleste patienter med T2DM vil i sidste ende kræver insulin for at opnå og opretholde glykæmisk kontrol, ved hjælp af en trinvis tilgang, der begynder med basal insulin kombineret med orale midler. Når præprandial og postprandial glykæmi ikke kontrolleres tilstrækkeligt, foretrækkes et insulinregime to gange dagligt med NPH (Neutral protamin Hagedorn) eller forblandede insulinpræparater som det næste trin., Som hos type 1-diabetikere bør basal-bolus insulinbehandling indikeres hos T2DM-patienter med svær insulinmangel, som ikke er i stand til at nå og opretholde glykæmiske mål med to gange daglig behandling.1 Imidlertid er dette insulinregime klart underudnyttet sandsynligvis på grund af modviljen hos patienter og læger på grund af kompleksiteten involveret i dets etablering samt den begrænsede information, der er tilgængelig om gennemførligheden, specielt hos ældre personer, og dens effektivitet hos patienter, der tidligere blev behandlet med to insulindoser.,2
i den foreliggende undersøgelse vurderede vi gennemførligheden, effektiviteten og sikkerheden ved basal-bolus insulinbehandling hos patienter med langvarig type 2-diabetes og dårlig eller ustabil glykæmisk kontrol.
Materiale og metoder
I denne prospektive, enkelt center undersøgelse, vi har indskrevet 37 patienter, som blev skiftet til basal-bolus insulin regime fra oktober 2006 til oktober 2007 og havde haft ustabile eller dårlig glykæmisk kontrol (glycated hæmoglobin (HbA1c)≥8%) i de forudgående seks måneder, på trods af intervention for at forbedre det., Undersøgelsesprotokollen blev godkendt af institutional ethics Revie.boards, og informeret skriftligt samtykke blev opnået fra alle patienter.
i den indledende behandling blev kulhydrater fordelt gennem de tre hovedmåltider. De første insulin glargine dosis beregnes som 50% af den tidligere samlede daglige dosis og den oprindelige prandial insulin (aspart eller lispro) som de resterende 50% af den samlede daglige dosis, som blev fordelt ligeligt, til at dække de tre måltider., Patienter, der tog metformin, før de skiftede behandlingen og ikke havde nogen kontraindikation for det, fortsatte med at bruge det i samme dosis. De andre orale antidiabetika blev stoppet.
alle patienter deltog i et struktureret diabetestræningsprogram, der bestod af tre 2-h-gruppesessioner på en uge for 5-8 patienter. Generelt blev de lært at følge en diæt under forudsætning af kvalitativt kulhydratindtag ved hvert måltid, skønt det for patienter, der ønskede at variere det, skulle kulhydratoptælling udføres., Patienter lærte også styringen af basal-bolus-behandlingen og hvordan man justerer basale insulindoser i henhold til fastende selvmonitorerende blodsukker (SMBG) hver 7.dag. Justering af prandial insulindosis blev udført i henhold til værdier før måltidet ved hjælp af en simpel algoritme med faste doser hurtigtvirkende insulin. Patienterne fulgte op på besøg leveret af sygeplejersken efter 1 og 3 uger, 3 og 6 måneder og af endokrinologen efter 2, 4 og 7 måneder, hvor diæt blev kontrolleret og dagbog med SMBG-værdier blev gennemgået for at justere insulindoser., Antropometriske data (vægt, kropsmasseindeks og taljeomkrets) samt behandling og biokemiske variabler blev opnået ved baseline og efter 3 og 6 måneder hos alle patienterne. Vi kvantificerede insulinbehov og antallet af svær hypoglykæmi (defineret som behov for hjælp) ved anamnese og en gennemgang af patienternes dagbøger.
HbA1c blev bestemt ved højtydende væskekromatografi (HPLC) (Bio-Rad Laboratories, m .nchen, Tyskland) med et referenceområde på 4,6-5,8%., Kolesterol og triglycerider blev bestemt ved standardiserede enzymatiske metoder og high-density lipoprotein kolesterol (HDLc) via en direkte metode (Roche Diagnostics, Basel, Schweiz). Lavdensitetslipoproteinkolesterol (LDLc) blev estimeret ved friede .ald-formlen (hvis triglyceridniveauer var
3, 39 mmol/l) eller ved ultracentrifugering. Apolipoprotein (Apo) B blev bestemt ved en inmunoturbidimetrisk metode (Tina-Diagnosuant, Roche Diagnostics) og LDL-størrelse ved elektroforese (2-16%)., Livskvaliteten blev målt ved hjælp af et sygdomsspecifikt spørgeskema tilpasset i Spanien fra Diabetes Qualityuality of Life (DCCT) ved baseline og gentaget 6 måneder efter basal-bolus insulinbehandling.3,4
Data blev analyseret af det Statistiske Program SPSS 15.0 (SPSS Inc.). Ændringerne i antropometriske variabler, HbA1c, insulinbehov og lipidprofil blev evalueret ved t af Student test. De blev betragtet som signifikante værdier på p 0.0 0,05.
resultater
de kliniske karakteristika ved baseline er opsummeret i tabel 1., Otteoghalvfjerds procent af patienterne var under behandling med 2 doser NPH eller forblandede insulinpræparater, 11% af patienterne tog orale lægemidler og sengetid insulin (glargin, detemir eller NPH), og de resterende 11% af patienterne brugte andre regimer med 3 doser NPH og regelmæssigt insulin. Firs-syv procent af patienter havde HbA1c koncentration >8% og 51% havde HbA1c>9%. Efter at have skiftet til basal-bolus-behandling, HbA1c faldet fra 9±1.2% til 8,1±1.2% (p
0.001) på 3 måneder og til 8,0±1.2% ved 6 måneder (p0.001) (Tabel 1, Fig. 1)., Procentdelen af patienter med HbA1c≥9% faldt fra de første 51% (19 forsøgspersoner) til 13, 8% og 18, 9%, henholdsvis efter 3 og 6 måneder. Fig. 2 viser andelen af patienter med en HbA1c7%, 7-8% og >8% før og efter skift til basal-bolus-behandling. Fem af patienterne viste en forværring i HbA1c-værdierne. Der var kun en episode af alvorlig hypoglykæmi registreret. Efter 6 måneder var alle patienter i stand til at justere den basale insulindosis, men kun 10 patienter ændrede prandialdosis i henhold til mønstrene for SMBG autonomt.,
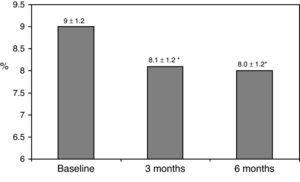
Glycated hemoglobin at baseline and 3 and 6 months after switching to basal-bolus regimen. *p0.001 compared to baseline. HbA1c: glycated hemoglobin.
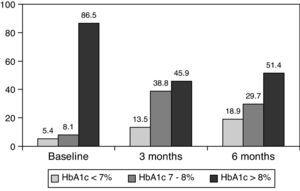
Percentage of patients with glycated hemoglobin 8% at baseline, and 3 and 6 months after switching to basal-bolus regimen.
legemsvægt, insulinbehov og lipidparametre ved baseline og under opfølgningen er vist i tabel 1. Kropsvægten forblev stabil i løbet af de 6 måneders opfølgning, og insulinbehovet (UI/kg/dag) ændrede sig ikke efter 3 måneder og steg lidt efter 6 måneder. Størrelsen af LDL-partikler er steget markant på 3 (25.77±0.48 nm vs 25.98±0,5 nm, p0.05) og 6 måneder (25.77±0.48 nm vs 25.94±0.44 nm, p0.05), mens den anden lipidic parametrene ikke ændres.,
Diskussion
i den foreliggende undersøgelse viste vi, at basal-bolus insulinbehandling tillader glykæmisk kontrol at forbedre sig uden at gå på kompromis med sikkerheden og livskvaliteten hos personer med langvarig type 2-diabetes, der tidligere blev behandlet med en eller flere insulindoser. Vi demonstrerer også muligheden for implementering af disse insulinregimer gennem et struktureret outpatient træningsprogram.,
Konsensus retningslinjer for håndtering af type 2-diabetes mener, at det primære mål for behandlingen er at opnå HbA1c så lave koncentrationer som muligt uden at forårsage uacceptable hypoglykæmi, især i ældre patienter, eller med koronar sygdom, og for at forhindre udvikling af mikrovaskulære og macrovascular komplikationer.1,5 desværre viser nylige undersøgelser, at en stor del af patienter med diabetes ikke opfylder de anbefalede glykæmiske mål.,6,7 Selv om der i den Nationale Sundhed og Ernæring Undersøgelse Survey (NHANES) andelen af patienter med HbA1c
7% er steget fra 37% i 1999-2000 til 56.8% i 2003-2004, priser for optimal glykæmisk kontrol er særlig høj hos personer med lignende karakteristika som dem, der er undersøgt af os, der har mangeårig diabetes eller insulin behandling.,6,7 to Gange daglig dosering med NPH-eller forblandet insulin bruges til at forenkle insulin regimer, men har begrænset fleksibilitet, kræver stiv overholdelse af regelmæssige måltider, begrænser muligheden for at justere dosis af de enkelte komponenter og øge muligheden for hypoglykæmi. Selvom mange patienter oprindeligt vil opnå tilstrækkelig glykæmisk kontrol med dette regime,8 når insulinsekretionskapacitet af beta-celler går tabt, og insulinmangel er alvorlig, bliver glykæmisk kontrol dårlig og ustabil som i de fleste af patienterne inkluderet i den nuværende undersøgelse.,1,8 Vi viste, at hos patienter med længerevarende type-2 diabetes, dårligt kontrolleret med andre regimer af insulin og ustabile profil, basal-bolus insulin regime reducerer HbA1c ét point over 6 måneder, og andelen af patienter med HbA1c≥9% fra 51% til 14% på 3 måneder og 19% ved 6 måneder. Dette skyldes sandsynligvis, at det er en mere fysiologisk terapi; mens prandial insulin erstatter første fase endogen insulinsekretion, nedsætter basalinsulin niveauet af fastende hyperglykæmi., Ud over niveauet af HbA1c 9 ændrer den måde, hvorpå behandlingen intensiveres, i høj grad de relative bidrag fra basal og postprandial hyperglykæmi til den samlede hyperglykæmi hos T2DM-patienter. For nylig, Riddle et al.10 viste, at efter behandlingsintensivering med insulin falder bidraget fra basal hyperglykæmi, men stadig tegner sig for ca.en tredjedel af den resterende hyperglykæmi. Derfor vil det ifølge resultaterne af den foreliggende undersøgelse ofte være nødvendigt at anvende insulinregimer, der kombinerer basal med prandial insulin for at opnå glykæmiske mål., I virkeligheden, disse resultater er i overensstemmelse med det store bevis for de fordele for basal-bolus-behandling af type 1-diabetes 11 og støttes af den begrænsede data fra observationsstudier i patienter med type 2-diabetes skifte fra forblanding til basal-bolus glargine-baseret regime 12,13 og en randomiseret sammenligning af en premix-baseret regime kontra et basal-bolus regime hos type 2 diabetiske patienter.2,14,15 hos patienter, der tidligere blev behandlet med glargin plus orale anti-diabetiske lægemidler, var forskellen i HbA1c 0.,22% til fordel for det basal-bolus glargin-baserede regime sammenlignet med et forblandet insulinregimen15. I de FORETRÆKKER undersøgelse,14 undergruppen af patienter, der tidligere på en basal insulin regime viste en større HbA1c-reduktion med detemir/aspart basal-bolus regime sammenlignet med bifasisk insulin aspart (-1.21% vs -0.75%). Endelig i premi.behandlede type 2 diabetespatienter, Fritsche et al. viste, at et basal-bolus glargin/glulisin-baseret insulinregime var bedre end et premi.insulinregime i reduktionen af HbA1c (-1, 31% mod 0, 8%).,2 Selv om der er forskelle i størrelsen af forbedring mellem undersøgelser, sandsynligvis på grund af de forskellige baseline-karakteristika for den studerede population, synes overlegenheden af et basal-bolus-regime hos udvalgte patienter med langvarig sygdom demonstreret. Reduktionen af mere end et punkt HbA1c opnået ved at skifte til et basal-bolus insulinregime kan betragtes som klinisk signifikant, fordi det kan resultere i reduktion af kliniske resultater., Desværre er basal-bolus-terapi underudnyttet hos patienter med T2DM, fordi læger anser det for komplekst at implementere, det er tidskrævende, og der er frygt for det øgede antal injektioner, risiko for hypoglykæmi, vægtøgning og forværring af livskvaliteten. I dette og tidligere undersøgelser blev kropsvægt og hastighed for svær hypoglykæmi ikke forøget,2,12 hvilket kunne relateres til den mere fysiologiske insulinsubstitution med basal-bolus-regime og den fleksibilitet, som denne terapi kan tilbyde patienter., Frygt for hypoglykæmi bør således ikke være en barriere for at starte denne form for terapi i T2DM, men det skal overvejes for at etablere glykæmiske kontrolmål, da det kan forårsage sygelighed og øget dødelighed.16 vedrørende virkningen på livskvaliteten i overensstemmelse med rapporten fra M .nard et al., 17 vores undersøgelse understøttede ikke synspunktet om, at basal-bolus-regimer fører til en nedsat livskvalitet.
ifølge en tidligere rapport var 12 i den nuværende undersøgelse alle patienter i stand til at titrere deres basale insulindosis i henhold til den faste SMBG i de sidste 3-7 dage., I modsætning hertil var få patienter i stand til at justere prandiale insulindoser i henhold til mønstrene for SMBG og havde mest brug for støtte fra en simpel algoritme med indstillet dosis afhængigt af blodglukose før måltider. Dette er ikke overraskende, da etablering af den optimale insulindosis ofte involverer beregninger, der overvejer flere faktorer og er vanskelige for nogle patienter. Desuden, ved hjælp af en simpel algoritme til at tilpasse måltiderne hurtigtvirkende insulin hver uge baseret på SMBG mønstre er lige så effektiv som at justere måltiderne insulin ved hjælp af insulin-til-kulhydrat nøgletal T2DM fag.,18
Begrænsninger af undersøgelsen er relateret til det potentielle observationsdesign og manglende kontrolgruppe. Disse aspekter og den korte opfølgning af patienter, vanskelige at fortolke resultaterne og deres anvendelighed til patienter med T2DM fulgte i andre centre. Selvom fremtidige undersøgelser i større grupper af patienter skal udføres for at bekræfte disse fund, giver undersøgelsen information, der kan være nyttig til håndtering af en fælles og dårligt behandlet klinisk situation.,
konklusionen er, at den foreliggende undersøgelse har vist, at en 9-timers ambulant program tilladt lang varighed T2DM patienter, dårligt kontrolleret med andre insulin regimer til at skifte til basal-bolus insulin regime. Vi bekræftede også, at basal-bolus insulin regime er effektivt, sikkert og ændrer ikke livskvaliteten i denne undergruppe af T2DM patienter. Behandling med BASALBOLUS kan således tilbydes T2DM-patienter, der ikke er tilstrækkeligt kontrolleret med andre insulinstrategier.
interessekonflikt
Irene Vinagre har modtaget forelæsningsgebyrer fra Eli Lilly, Novo Nordisk og Sanofi Aventis., Antonio Pere.har modtaget honorarer fra Eli Lilly, Novo Nordisk og Sanofi Aventis.