læringsmål
- Angiv korrosion
- Liste over nogle af de metoder, der anvendes til at forhindre eller bremse korrosion
Korrosion er normalt defineret som en forringelse af metaller på grund af en elektrokemisk proces. Dannelsen af rust på jern, plette på sølv, og den blågrønne patina, der udvikler sig på kobber, er alle eksempler på korrosion., De samlede omkostninger ved korrosion i USA er betydelige, med skøn over en halv billioner dollars om året.
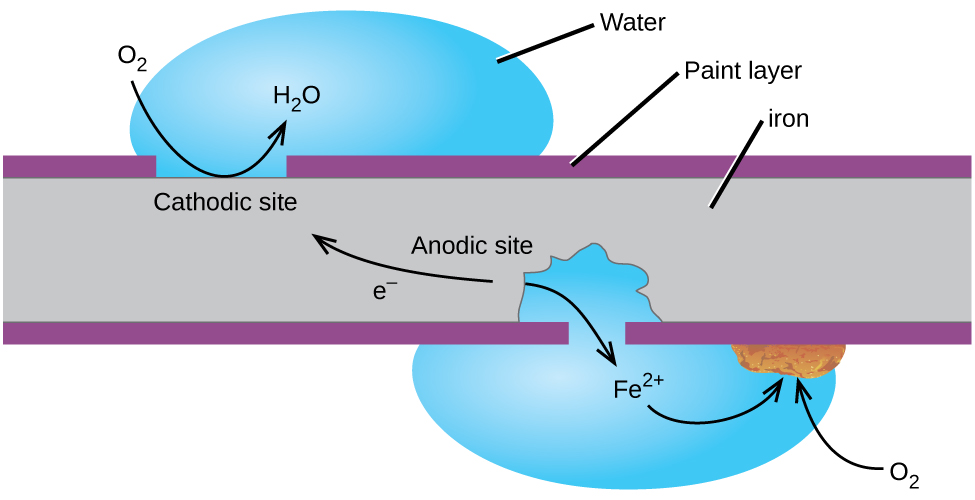
måske er det mest kendte eksempel på korrosion dannelsen af rust på jern. Jern vil ruste, når det udsættes for ilt og vand. De vigtigste trin i rustning af jern synes at involvere følgende (figur 2). Når det er udsat for atmosfæren, o .iderer jern hurtigt.
elektronerne reducerer ilt i luften i sure opløsninger.
det, vi kalder rust er hydreret jern(III) oxid, som former, når jern(II) ioner reagerer videre med ilt.,
antallet af vandmolekyler, der er variabel, så det er repræsenteret af x. I modsætning til den patina på kobber, dannelse af rust, der ikke skaber et beskyttende lag, og så korrosion af jern fortsætter som rust flager ud og udsætter friske jern til atmosfæren.
en måde at forhindre jern i at korrodere er at holde det malet. Malingslaget forhindrer vand og ilt, der er nødvendigt for rustdannelse, i at komme i kontakt med jernet. Så længe malingen forbliver intakt, er jernet beskyttet mod korrosion.,
andre strategier omfatter legering af jern med andre metaller. For eksempel er rustfrit stål for det meste jern med lidt krom. Krom har tendens til at samle sig nær overfladen, hvor det danner et O .idlag, der beskytter jernet.
galvaniseret eller galvaniseret jern bruger en anden strategi. Moreink o .ideres lettere end jern, fordi .ink har et lavere reduktionspotentiale. Da potentialink har et lavere reduktionspotentiale, er det et mere aktivt metal. Selv om scratchedinkbelægningen er ridset, vil zinket stadig o .idere før jernet., Dette tyder på, at denne tilgang skal fungere med andre aktive metaller.
en anden vigtig måde at beskytte metal på er at gøre det til katoden i en galvanisk celle. Dette er katodisk beskyttelse og kan bruges til andre metaller end bare jern. For eksempel kan rustning af underjordiske jernopbevaringstanke og rør forhindres eller reduceres kraftigt ved at forbinde dem til et mere aktivt metal, såsom .ink eller magnesium (figur 3). Dette bruges også til at beskytte metaldele i vandvarmere., De mere aktive metaller (lavere reduktionspotentiale) kaldes offeranoder, fordi de bliver brugt op, når de korroderer (o .iderer) ved anoden. Det metal, der er beskyttet, tjener som katoden, og det o .iderer ikke (korroderer). Når anoderne overvåges korrekt og udskiftes med jævne mellemrum, kan jernopbevaringstankens nyttige levetid forlænges kraftigt.
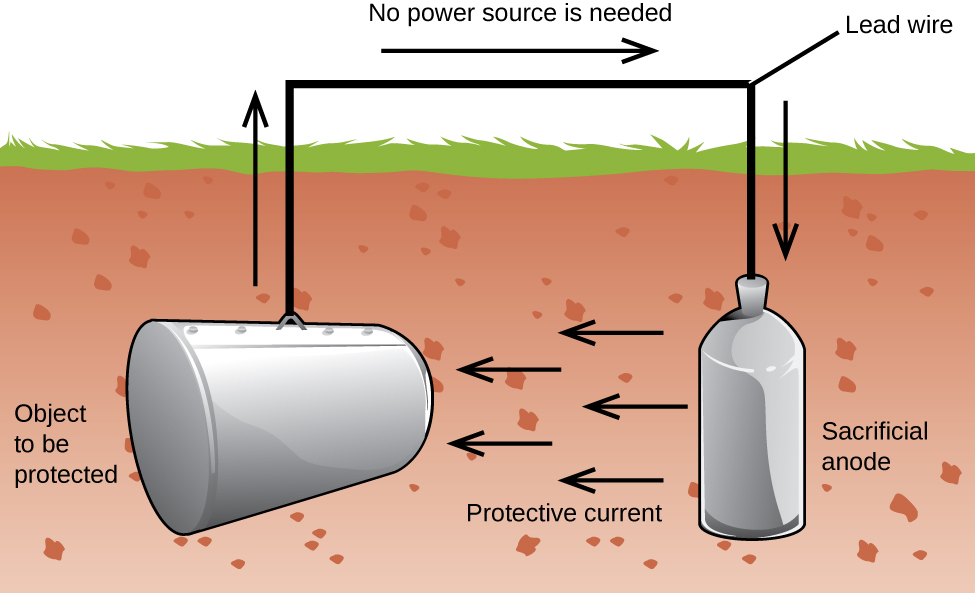
Korrosion er den nedbrydning af metal forårsaget af en elektrokemisk proces. Store pengesummer bruges hvert år på at reparere virkningerne af eller forebygge korrosion. Nogle metaller, såsom aluminium og kobber, producerer et beskyttende lag, når de korroderer i luft., Det tynde lag, der dannes på overfladen af metallet, forhindrer ilt i at komme i kontakt med flere af metalatomerne og således “beskytter” det resterende metal mod yderligere korrosion. Jern korroderer (danner rust), når det udsættes for vand og ilt. Den rust, der dannes på jernmetal, flager af og udsætter frisk metal, som også korroderer. En måde at forhindre eller langsom korrosion er ved at belægge metallet. Belægning forhindrer vand og ilt i at komme i kontakt med metallet. Maling eller andre belægninger vil bremse korrosion, men de er ikke effektive, når de er ridset., Galvaniseret eller galvaniseret jern udnytter det faktum, at zink er mere tilbøjelige til at O .idere end jern. Så længe belægningen forbliver, selvom den er ridset, vil ironinket o .idere før jernet. En anden metode til beskyttelse af metaller er katodisk beskyttelse. I denne metode er et let o .ideret og billigt metal, ofte .ink eller magnesium (offeranoden), elektrisk forbundet til det metal, der skal beskyttes. Det mere aktive metal er offeranoden og er anoden i en galvanisk celle. Det” beskyttede ” metal er katoden og forbliver uo .ideret., En fordel ved katodisk beskyttelse er, at offeranoden kan overvåges og udskiftes om nødvendigt.,
Ordbog
katodisk beskyttelse metode til at beskytte metal ved hjælp af en sacrificial anode og effektivt gør det metal, der skal beskytte katoden, hvilket forhindrer oxidation korrosion, nedbrydning af metal gennem en elektrokemisk proces, galvaniseret jern metode til beskyttelse af jern ved at dække det med zink, der vil oxidere, før jern, zink belagt strygejern sacrificial anode mere aktiv, billig metal, der anvendes som anode i katodisk beskyttelse; ofte lavet af magnesium eller zink
Løsninger
Svar til Kemi Slutningen af Kapitel Øvelser
2., Mg og 4n
4. Begge eksempler involverer katodisk beskyttelse. Den (offer) anode er det metal, der korroderer (o .iderer eller reagerer). I tilfælde af jern (-0.447 V) og .ink (-0.7618 V) har ironink et mere negativt standardreduktionspotentiale og fungerer således som anoden. I tilfælde af jern og kobber (0,34 V) har jern det mindre standardreduktionspotentiale og korroderer således (tjener som anode).
6., Mens reduktionspotentialet for lithium ville gøre det i stand til at beskytte de andre metaller, er dette høje potentiale også tegn på, hvor reaktivt lithium er; det ville have en spontan reaktion med de fleste stoffer. Dette betyder, at lithium ville reagere hurtigt med andre stoffer, selv dem, der ikke ville o .idere det metal, det forsøger at beskytte. Reaktivitet som dette betyder, at offeranoden ville blive udtømt hurtigt og skal udskiftes ofte. (Valgfri yderligere grund: brandfare i nærvær af vand.)