Indledning
Nuklear faktor kappa B (NF-kB) er en gammel protein transskription faktor (Salminen et al., 2008) og betragtes som en regulator for medfødt immunitet (Baltimore, 2009). NF-kB-signalvejen forbinder patogene signaler og cellulære faresignaler og organiserer således cellulær resistens over for invaderende patogener., Faktisk har en overflod af undersøgelser vist, at NF-kB er et netværkshub, der er ansvarlig for kompleks biologisk signalering (Albensi og Mattson, 2000; Kaltschmidt og Kaltschmidt, 2009; Karin, 2009). Til dette formål er NF-kB blevet antaget at være en mesterregulator for evolutionært bevarede biokemiske kaskader (Mattson et al., 2000). Andre faktorer oversættes også til mitokondrier og er involveret i modulerende udtryk (Barshad et al., 2018a), men er ikke i fokus for denne anmeldelse., Formålet med denne gennemgang er at forsøge at forstå, hvordan NF-kB-aktivitet bidrager til mitokondriel funktion. Det antages, at læseren allerede har en forståelse af grundlæggende mitokondrielbiologi. I tilfælde af en ny undersøgelse, henvises læseren til mange gode undersøgelser og vurderinger på mitokondrie-struktur og funktion (Hall, 1979; Fox, 1982; Roger og Silberman, 2002; Henze og Martin, 2003; Conradt, 2006; Ettema, 2016; Wang og Youle, 2016; Barshad et al., 2018b).,
NF-kB-aktivering
Nuclear factor kappa B-underenheder, der omfatter NF-kB-komplekset, udtrykkes i både neuroner og glia. NF-kB-komplekset findes i en inaktiv tilstand i cytoplasmaet (Ghosh et al., 1998; Aggar ;al et al., 2004; Hayden og Ghosh, 2004), hvor aktivering af NF-kB har været godt beskrevet (Li og Karin, 2000; Baud og Jacque, 2008; Israel, 2010). Når TNFa stimuleres af molekyler som TNFa eller andre cellestressorer, binder TNFa sig til TNF-receptorer (Figur 1)., Denne bindende, via flere mellemliggende trin, fører til en interaktion med IkB-kinase (IKK) – kompleks, som derefter fører til fosforylering af IkB, og efterfølgende resultater i IkB ubiquitination og nedbrydning. P65 / P50-underenheder) translokeres til kernen, hvor den binder til DNA-konsensussekvensen af forskellige målgener. Selektiviteten af NF-kB-responsen er baseret på flere faktorer (Sen og Smale, 2010), herunder dimer-sammensætning, timing og celletype., NF-kB ‘ s indflydelse på celleoverlevelse er også kompleks og kan være neurobeskyttende eller proinflammatorisk, afhængigt af celletype, udviklingsstadium og patologisk tilstand (.in et al., 2007).
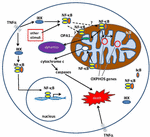
Figur 1. Veje til Nuklear faktor κ B (NF-kB) signalering i cytoplasma og mitokondrier. NF-kB tri-subunt-komplekset (f.p65, P50, IkB – en mulig kombination) findes i en inaktiv tilstand i cytoplasmaet. NF-kB-aktivering initieres, når molekyler som TNFa binder til TNF-receptorer (forskellige typer findes)., Andre eksterne eller interne stimuli kan også aktivere NF-kB. En kompliceret signaltransduktionsproces begynder derefter, når TNF-receptorer er aktiveret; IkB-kinase (IKK) udløses i sidste ende og fører til phosphorylering af IkB, hvilket resulterer i IkB UBI .uitination og nedbrydning. Når IkB er nedbrudt, er de resterende NF-kB dimer (f.p65/P50 eller P50/P50 underenhedskombinationer mulige) translokerer til kernen, hvor den binder til en DNA-konsensussekvens af målgener., Ved processer, der ikke er godt forstået, kan NF-kB-komplekset eller NF-kB-underenhederne også migrere ind i mitokondrionet, hvor bevis tyder på det/de optager intermembranrummet. Når man først er inde i mitokondrierne, menes NF-kB at interagere med o .phos-gener (mitokondriel mtDNA), der fører til ekspression af proteiner involveret i forskellige funktioner, herunder mitokondriel dynamik og co.III-regulering (komponent af kompleks IV)., Beviser antyder også, at NF-kB kan fungere som en s .itch i mitokondrierne og kontrollere balancen mellem udnyttelsen af cytoplasmatisk glykolyse og mitokondriel respiration i normale celler og i kræft. Endelig peger data også på iboende apoptotisk stimulation, hvor NF-kB-aktivering i mitokondrierne fører til cytokrom C-frigivelse, hvilket således udløser caspase-kaskader og programmeret celledød.,
Organisatorisk, NF-kB er et Rel familie transskription faktor, og det er forbundet med fem gener, NF-kB1, NF-kB2, RELA, RELB, og REL (Chen og Greene, 2004); disse gener indkode flere proteiner, NF-kB1, NF-kB2, RelA, RelB, og c-Rel, henholdsvis hvor to af disse proteiner er store forløber proteiner kendt som p105 og p100 at gennemgå proteolyse at blive p50 og p52, hhv. Disse proteiner indeholder rel-homologi domæner (RHD) på deres amino-terminal region; RHD-regionen er sammensat af 2 separate, men tilstødende domæner., Den sekvens, der er fjernest fra den Carbo .yterminale region, tillader proteinet at binde til DNA. En mere indvendig sekvens gør det muligt for rel-familieproteinerne at dimerisere (homo – eller heterodimerer) til undertrykkelse af ekspression via bindingen af deres tilsvarende familie af inhibitorer, IkB-proteinerne (Chen og Greene, 2004). Sidstnævnte sekvens omfatter nuklear-lokalisering sekvens (NLS), der bliver afmasket, når IkB er ubundet ved nedbrydning. NLS har til opgave at vejlede eller mærke aktive proteiner til import i cellekernen (Chen og Greene, 2004; Karin et al., 2004; Barger et al.,, 2005).
tre af disse proteiner (RelA, RelB og c-REL) koder også et transaktionsdomæne (TADs) i deres Carbo .y-terminale region. Den TADs tillade, at disse proteiner til at interagere med basal transskription apparater, der er kendt som TATA bindende protein (TBP), Transskription Faktor, IIB, samt p300 og cAMP response element (CREB) – bindende protein (CBP) transkriptionel co-aktivatorer (Chen og Greene, 2004)., Kun disse tre proteiner er i stand til at inducere transkription af deres DNA-kodende regioner, mens de andre proteiner, P50 og P52 homodimerer, er i stand til at besætte DNA-bindingsstederne uden at indlede transkription. I betragtning af dette fungerer de senere 2 homodimerproteiner af p50 og P52 som transkriptionelle undertrykkere (Chen and Greene, 2004).
P105-og P100-homodimerne optager DNA-bindingssteder, hvilket blokerer transkription via transkriptionsfaktorer, der besidder TADs (Barger et al., 2005). En tredje form for transkriptionel undertrykkelse skyldes IkB-proteiner., Disse proteiner har flere ankyrin-gentagelser som deres kernedomæne og funktion ved at binde til RHD, der maskerer NLS (Karin et al., 2004). Uden en aktiv NLS er NF-kB-proteinerne begrænset til cytoplasmaet og er ikke i stand til at migrere ind i kernen, og derfor blokeres transkription.
NF-kB findes i mitokondrier
i 2001, en undersøgelse af Bottero et al. (2001) fundet IkBa og NF-kB p65 underenhed i subcellulære fraktioner og oprensede mitokondrier fra Jurkat celler. Jurkat-celler er en udødeliggjort cellelinie af humane T-lymfocytceller, der bruges til at studere leukæmi., I Botteros undersøgelse blev det fastslået, at IkBa og NF-kB p65 var lokaliseret i det mitokondrielle intermembrane rum. Det mitokondrielle intermembrane rum er det rum, der findes mellem den indre mitokondrielle membran (IMM) og den ydre mitokondrielle membran (omm).
efterfølgende COGS .ell et al. (2003) viste også, at NF-kB underenheder, p50 og p65, og IkBa, blev fundet i mitokondrierne. For at bestemme dette blev flere metoder anvendt til at fremlægge bevis, herunder elektronmikroskopi af sektioner af U937 celler., U937 celler blev først isoleret fra lymfom hos en middelaldrende mandlig patient for at studere adfærd og differentiering af monocytter. Her COGS .ell et al. (2003) var i stand til at visualisere NF-kB p50 og P65 underenheder og IkBa i den indre Matri.af mitokondrier. Rotteleverceller blev også undersøgt i denne undersøgelse, og P50-underenheden og IkBa-underenheden blev også identificeret. Derudover blev u937-celler stimuleret i 1 time med TNFa, en kendt trigger af NF-kB-signalvejen., I dette eksperiment, Western blotting i mitokondrie-og cytoplasmatisk fraktioner fandt, at TNFa behandling forårsaget et tab af IkBa i både mitokondrie-og cytoplasmatisk rum med 30 min efter behandling, hvilket tyder på, at IkBa blev nedbrudt. EMSA analyse, en in vitro-analyse, der påviser NF-kB aktivering og ikke-specifik binding til DNA-sekvenser, blev også gennemført på protein taget fra nukleare uddrag fra mitochondrier isoleret fra U937 celler stimuleres med TNFa., Her bestemte de TNFa-signalering førte til øget DNA-bindingsaktivitet af NF-kB P50 i protein taget fra mitokondrier.
andre undersøgelser har også påvist NF-kB i mitokondrierne. Disse omfatter undersøgelser (Guseva et al., 2004; 2004amora et al., 2004) i humane fibroblast HT1080 cellelinjer, human prostata LNCaP og PC3 cellelinjer, og HeLa celler. I LNCaP-celler blev mitokondrier NF-kB p50-og p65-underenheder fundet bundet til mitokondrielt DNA (mtDNA)., Samlet set viser disse undersøgelser bevis for NF-kB-signalering i mitokondrierne, og at NF-kB regulerer mitokondriel mRNA-ekspression (se afsnittet NF-kB og mitokondrielt genekspression nedenfor).
NF-kB Kontrol Mitokondrie Dynamics
Der er flere proteiner, der er involveret i dynamikken (fission og fusion) og morfologi af mitokondrier (Karbowski og Youle, 2003; Olichon et al., 2006; Brooks and Dong, 2007; Song et al., 2008; Autret and Martin, 2010; Silva et al., 2013; Sinha og Manoj, 2019). Et af disse er optic atrofi 1-proteinet (Opa1) (Olichon et al.,, 2006; Garcia et al., 2018; Lee og Yoon, 2018). Undersøgelser har antydet, at opa1 er en regulator for mitokondriel indre membranfusion og også mitokondriel cristae-remodeling (Cipolat et al., 2006). For nylig LaForge et al. (2016) viste, at fraværet af IKKa havde indflydelse på opa1-ekspression i mitokondrierne og på mitokondriel morfologi.
overraskende i en nylig undersøgelse af Nan et al. (2017) blev TNFa-receptor 2 (tnfr2)-stimulering fundet at fremme mitokondriel fusion via den NF-kB-afhængige aktivering af opa1-ekspression i hjertemyocytter., Det er vigtigt, at tnfr2-aktivering i denne undersøgelse beskyttede hjertemyocytter mod stress ved at regulere opa1-ekspression. Ved administration af lave koncentrationer af eksogene TNFa (0.5 ng/mL) før iskæmi-reperfusion medvirket til at øge celle overlevelse, mens højere koncentrationer (10-20 ng/mL) førte til toksiske effekter i celler.
NF-kB, og Apoptose i Mitokondrierne
Mitokondrier ‘ s rolle i programmeret celledød eller apoptose har været kendt i nogen tid (Grøn og Reed, 1998; Wang og Chen, 2015)., Den vigtigste rolle for mitokondrier er genereringen af ATP; imidlertid er den næstvigtigste funktion for mitokondrier sandsynligvis i at kontrollere celledød. Hvordan gør mitokondrionen dette? Hvis mitokondrionen mislykkes ved at udløse celledød, er kræft ofte konsekvensen. Så for at regulere celledød integrerer mitokondrier signaler fra en række kilder, der er kendt som indre veje for apoptose. Komponenter af NF-kB-aktivitet synes at være et af disse signaler, selvom TNFa, en aktivator af NF-kB, er en del af en ekstrinsisk vej af apoptose., Ekstrinsiske veje (dødsreceptormedieret) initieres uden for cellen, hvorimod indre veje for apoptose medieres og udløses i mitokondrier.
i en nylig undersøgelse af pa .arent .os et al. (2014) viste IkBa at udøve pro-apoptotisk aktivitet, da den hæmmede den anti-apoptotiske NF-kB. I de fleste celler fører aktiveringen af NF-kB til nedstrøms målgenekspression, der udløser celledødsresistens (Luo et al., 2005). I denne undersøgelse blev det vist, at en ny apoptosefunktion skyldtes IkBa, underenheden, der hæmmer NF-kB ‘ s aktivering. Pa .arent .os et al., (2014) fandt, at IkBa lokaliserer til OMM, hvor det vekselvirker med en spænding afhængig anion-kanal (VDAC) og mitokondriel hexokinase II (HKII) til at stabilisere denne komplekse og forhindre Bax-medieret cytochrom c overgang til apoptose. Ba.er medlem af Bcl-2-familien af proteiner, som har vist sig at være regulatorer af programmeret celledød (Karbo .ski et al., 2006).
andre undersøgelser har også antydet NF-kB ‘ s rolle i mere direkte regulering af apoptose i mitokondrionen. I en undersøgelse af Liu et al., (2004), hæmning af NF-kB alene i makrofager resulterede i udgivelsen af cytochrom c. Husk på, at cytochrom c er ansvarlig for pendling elektroner fra Komplekse III til Komplekse IV og at frigivelsen af cytochrom c i cytoplasmaet, en aktivator af caspases, er et vigtigt skridt i at udløse apoptose.
NF-kB og Mitochondrial Respiration
Nuclear factor kappa B er blevet vist i mange undersøgelser for at fremme tumorigenese. Hvordan dette sker var ikke helt klart. I en banebrydende undersøgelse af Mauro et al., (2011) viste NF-kB at opregulere mitokondriel respiration i tyktarmscarcinomceller. Her fastslog de, at denne funktion af NF-kB undertrykker effectarburg-effekten. Husk at effectarburg-effekten (Vander Heiden et al., 2009) beskriver observationen, at kræftceller har en tendens til at favorisere metabolisme ved glycolyse snarere end ved den mere effektive o .idative phosphoryleringsvej. Så i denne undersøgelse fastslog forfatterne, at NF-kB organiserer netværk af energimetabolisme ved at kontrollere balancen mellem glycolyseudnyttelse og mitokondriel respiration., Interessant nok fandt de en rolle for NF-kB i metabolisk tilpasning i normale celler og i kræft. Deres resultater antydede yderligere, at undertrykkelse af mitokondriel metabolisme i etablerede kræftceller ved hæmning af NF-kB og metformin nedsætter tumorigenese.
NF-kB og mitokondrielt genekspression
Kernefaktor kappa B er en kendt regulator for genekspression – både negativt og positivt (Mattson et al., 2000). Hvordan NF-kB regulerer eller påvirker nukleært kodet mitokondrielt genekspression forstås imidlertid mindre., Human mtDNA besidder 37 gener, der koder for 13 polypeptider. Det har vist sig, at mtDNA-gener kode for mange af underenhederne af alle 5-komplekser i elektrontransportkæden (ETC), 2 rRNA ‘er og 22 tRNA’ er. Omend de fleste ETC-underenheder er kodet af nukleart DNA, som kunne påvirkes af NF-kB-aktivitet (Calvo et al., 2016).
for eksempel er det blevet hævdet (COGS .ell et al., 2003), at NF-kB-vejen negativt kan regulere mitokondrielt genekspression forbundet med CO.III-underenheden., Co.III-underenheden er kodet af mtDNA og er en komponent af kompleks IV i mitokondrial osv. Det fungerer som en katalytisk underenhed i kompleks IV, som er komplekset forbundet med mitokondrielt iltforbrug. I en undersøgelse af COGS .ell et al. (2003) resulterede modulering af NF-kB-aktivering i tab af ekspression af både Co.III og cytochrom B mRNA. Andre undersøgelser understøtter en rolle for NF-kB, der regulerer yderligere mitokondrielle gener, såsom CO.i og Cytb (Psarra og Sekeris, 2008, 2009; Barshad et al., 2018b)., Derudover reducerede NF-kB p65-underenhed niveauer af mtDNA-kodet CytB-mRNA, muligvis ved at binde til D-sløjfen i humane celler i fravær af p53 (Johnson et al., 2011). Samlet set antyder disse resultater, at NF-kB-signalering kan påvirke den en .ymatiske aktivitet af respiratoriske ETC-komplekser.
NF-kB Formidler Aß-Induceret Dysfunktion i Mitokondrierne
Alzheimers sygdom (AD) er forbundet med opbygningen af Aß plaques og/eller udseendet af neurofibrillary tangles (NFTs) i visse områder af hjernen (Duyckaerts et al., 2009)., Der findes imidlertid kontroverser omkring, om Aß er et forårsagende middel til AD, eller om a.simpelthen er korreleret med aldring. Akkumulerende bevis (Aliev et al., 2009; Correia et al., 2012; Cadonic et al., 2016; Cardoso et al., 2017; Djordjevic et al., 2017) peger nu også på ændringer i hjernemetabolisme drevet af mitokondriel dysfunktion som en proces, der er central for mange aldersrelaterede neurodegenerative lidelser, herunder AD. Tilføjelse til denne dokumentation, er der også problemer i enzymatiske aktivitet af protein komplekser af det OSV., og ændringer i antioxidant enzymatisk aktivitet (Kolosova et al.,, 2017) i AD. Især har kompleks IV-aktivitet vist sig at være negativt påvirket i AD(Mutisya et al ., 1994).
i en nylig undersøgelse af Shi et al. (2014) blev det konstateret, at Aß nedsat mitokondriel funktion via NF-kB signalering. Desuden Shi et al. (2014) viste her, at a.reducerede udtrykket af CO. III-underenheden via en NF-kB-vej., Vigtigere er, at fjerne muligheden for, at IkBa var phosphoryleres af Aß i cytoplasma (og derefter transporteres ind i mitokondrierne), isolerede mitokondrier blev inkuberet med Aß i tilstedeværelsen (eller fraværet) af en NF-kB-blocker, nemlig BAY11-7082. Her fandt de Aß induceret phosphorylering og nedbrydning af IkBa i isolerede mitokondrier.
disse fund har også vigtige konsekvenser for AD-behandling, som det fremgår af nylige undersøgelser af SNO.et al. (2018) og som vist i andre relaterede undersøgelser (Djordjevic et al., 2017; Adlimoghaddam et al.,, 2019), der antyder at målrette mod NF-kB-signalering i mitokondrier, kan have terapeutisk værdi. For eksempel i sne et al.’s undersøgelse, kreatin – en kendt modulator af mitokondrie-funktion (Tarnopolsky og Beal, 2001), var vist at øge og positivt ændre protein niveauer af CaMKII, PSD-95, og Komplekst 1 underenheder i kreatin fed mus, der henviser til, at NF-kB hæmmende IkB-underenheden var faldet. For yderligere læsning af kreatins potentielle terapeutiske virkning på mitokondriel funktion og i mitokondrielle lidelser eller andre neurologiske lidelser se undersøgelser og anmeldelser af Matthe .s et al., (1998), Klivenyi et al. (1999), Tarnopolsky and Beal (2001), Hersch et al. (2006), Rodrigue.et al. (2007) og Beal (2011).
NF-kB ‘ s rolle i Inflammation og mitokondriel metabolisme
stigende data (Lamas et al., 2003; Mauro et al. , 2011; Moretti et al., 2012) antyder, at NF-kB-signalering, som er en mediator af inflammatoriske processer, også fungerer som en regulator og integrator med energimetabolisme. I en nylig undersøgelse af .hong et al. (2016) blev NF-kB vist at begrænse inflammatorisk aktivering via eliminering af beskadigede mitokondrier., Overraskende syntes NF-kB både at prime nlrp-3 inflammasomet til aktivering og forhindrede også overdreven betændelse og fastholdt nlrp-3 inflammasomaktivering; selvom mekanismen til tilbageholdenhed var dårligt defineret. Her blev det spekuleret i, at ud over at NF-kB var en aktivator af inflammatoriske gener, fungerede det også i denne undersøgelse ved at begrænse NLRP3 inflammatorisk aktivering og IL-1β produktion. Desuden blev det konstateret, at P62-induktion var ansvarlig for den inflammatoriske hæmmende aktivitet af NF-kB., Det ser ud til, at NF-kB kan begrænse sin egen betændelse i makrofager ved at fremme p62 medieret fjernelse af beskadigede mitokondrier (mitophagy) efter makrofager interagere med forskellige NLRP3 inflammasome aktivatorer.
konklusion
for over 10 år siden blev NF-kB påvist i mitokondrierne. Overraskende nok er der for en så vigtig transkriptionsfaktor gjort små fremskridt med at afdække specifikke roller for NF-kB, der påvirker mitokondrionen., Nogle undersøgelser, som beskrevet ovenfor, giver bevis for NF-kB i mitokondriel dynamik, apoptose, respiratorisk kontrol, genekspression og sygdomsmekanismer (Figur 1). Det er dog stadig nødvendigt at duplikere disse resultater og den samlede validering af andre laboratorier. Nogle yderligere indsigt kan udledes af det faktum, at andre transkriptionsfaktorer, der har indvirkning på nukleare gener, såsom AP-1, p53, CREB, c-Myc, Wnt13, Dok-4, HMGA1, og c-Src er også blevet påvist i mitokondrierne (Psarra og Sekeris, 2008)., Interessant nok er bindingssteder i det mitokondrielle genom (homologe med deres bindingssteder i det nukleare DNA) for nogle af disse faktorer blevet bestemt (Psarra og Sekeris, 2008), hvor roller for mitokondriel transkription og apoptose mistænkes og viser nogle overordnede aktivitetsmønstre. For eksempel kan der argumenteres for, at nogle af disse faktorer (NF-kB, CREB og AP-1) binder til mitokondrielle genomer og for det meste dæmper mitokondrielt genekspression (Blumberg et al., 2014), samtidig med at de har stimulerende virkninger på nuklear gentranskription., Det er imidlertid klart, at der er behov for mere arbejde for ikke kun at finde præcise aktivitetsroller, men også for at afgøre, om der virkelig findes overordnede aktivitetsmønstre.
efter undersøgelse af denne litteratur bliver det også tydeligt, at NF-kB ‘ s rolle i reguleringen af mitokondriel respiration har dybe konsekvenser og demonstrerer et niveau af kompleksitet, som ikke tidligere er værdsat. For eksempel Mauro et al. (2011) data oprette en rolle for NF-kB i metabolisk tilpasning i normale celler og i kræft, og foreslår også konsekvenser for andre sygdomstilstande såsom ANNONCE., I betragtning af at NF-kB kan begrænse sin egen betændelse som vist af .hong et al. (2016) er ikke kun overraskende, men eksemplificerer yderligere kompleksiteten af NF-kB-signalering i mitokondriel funktion.
i denne gennemgang blev der undersøgt undersøgelser af NF-kB ‘ s rolle i mitokondriel funktion, og det ser ud til, at forskningen på dette område er stigende. Komplicering af resultaterne er dog observationen af, at flere faktorer spiller lignende roller i mitokondriel funktion, og så detaljerede undersøgelser, der er specifikke for hver faktor, er nødvendige., Afslutningsvis kan vi stille spørgsmålet igen-Hvad laver NF-kB i og til mitokondrionen? Det øjeblikkelige og forkortede svar ville være-meget!
forfatter Bidrag
forfatteren skabte emnet og skrev manuskriptet.
Finansiering
Dette arbejde blev støttet af tilskud fra den Canadiske Institutes of Health Research (CIHR), Dansk Landbrugs-Partnerskab (CAP), St. Boniface Hospital Research Foundation, Alzheimers Society of Manitoba, Forskning, Manitoba, Det Ærede Douglas og Patricia Everett, og Royal Canadian Egenskaber Begrænset Endowment Fund.,
Erklæring om interessekonflikt
forfatteren erklærer, at forskningen blev udført i mangel af kommercielle eller økonomiske forhold, der kunne fortolkes som en potentiel interessekonflikt.
anerkendelser
forfatteren vil gerne takke Dr. Grant Hatch for en gennemgang af manuskriptet.
Hayden, M. S., and Ghosh, S. (2004). Signalering til NF-kappaB. Gener Dev. 18, 2195–2224.
PubMed Abstract | Google Scholar
Wang, X. og Chen, X. J. (2015)., Et cytosolisk netværk, der undertrykker mitokondrier-medieret proteostatisk stress og celledød. Natur 524, 481-484. doi: 10.1038/nature14859
PubMed Abstract | CrossRef Fuld Tekst | Google Scholar