Den Brønsted-Lowry Teori om Syrer og Baser
Brønsted-Lowry teori om syre og baser tog Arrhenius definition et skridt videre, som et stof, der ikke længere er behov for at være sammensat af brint (H+) eller hydroxid (OH-) ioner for at blive klassificeret som en syre eller base. For exmapl, skal du overveje følgende kemiske ligning:
\
- En Brønsted-Lowry syre er en proton (hydrogen ion) donor.en Brønsted-lo .ry base er en proton (hydrogenion) acceptor.,
i denne teori er en syre et stof, der kan frigive en proton (som i Arrhenius-teorien), og en base er et stof, der kan acceptere en proton., En grundlæggende salt, som Na+ – F-, genererer OH – ioner i vand ved at tage protoner fra vand i sig selv (for at gøre HF):
\
- Syre dissociation
\
- Syre Ionisering Konstant:
\}{}\]
- Base dissociation:
\
- Base i Kølevandet Konstant
\}{}\]
bestemmelse af et stof som et Brønsted-Lowery syre eller base kan kun gøres ved at observere reaktionen. I tilfælde af HOH er det en base i det første tilfælde og en syre i det andet tilfælde.,
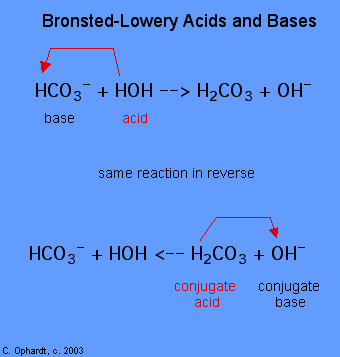
for At afgøre, om et stof er en syre eller en base, tæller brintatomerne om hvert enkelt stof før og efter reaktionen. Hvis antallet af hydrogener er faldet, er stoffet syren (donerer hydrogenioner). Hvis antallet af hydrogener er steget, er stoffet basen (accepterer hydrogenioner). Disse definitioner anvendes normalt på reaktanterne til venstre. Hvis reaktionen ses omvendt, kan en ny syre og base identificeres., Stofferne på højre side af ligningen kaldes konjugatsyre og konjugatbase sammenlignet med dem til venstre. Bemærk også, at den oprindelige syre vender i konjugatbasen, efter at reaktionen er overstået.
Note
syrer er Protondonorer, og baser er Protonacceptorer
For at en reaktion skal være i ligevægt, skal der ske en overførsel af elektroner. Syren vil give en elektron væk, og basen vil modtage elektronen. Syrer og baser, der arbejder sammen på denne måde kaldes en konjugat par består af konjugat syrer og konjugat baser.,
\
a står for en sur forbindelse, og and står for en basisk forbindelse
- A donerer H til dannelse af h.+.
- Z Accepterer H fra En, der former HZ+
- Et – bliver konjugerede base i HA og i den modsatte reaktion det accepterer en H fra HZ for at genskabe HA for at forblive i ligevægt
- HZ+ bliver en konjugerede syre af Z-og i den modsatte reaktion det giver en H til – genskabelse af Z for at forblive i ligevægt