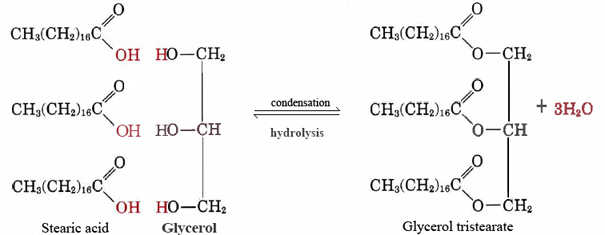
Et godt eksempel på en upolære lipid er den neutrale fedt, glycerol tristearate. Denne mest almindelige form for animalsk fedt tjener som et lagerhus til energi og som isolering mod varmetab. På molekylært niveau, det er opbygget af tre molekyler af stearinsyre og en af glycerol:
 (1)
(1)
rigtig mange upolære lipider kan gøres ved at kombinere forskellige langkædede fedtsyrer med glycerol., Fordi disse syrer oprindeligt stammer fra fedtstoffer, kaldes de kollektivt fedtsyrer.
Bemærk, at for hvert stearinsyre eller andet fedtsyremolekyle, der kombinerer med en af —OH-grupperne glycerol, afgives et molekyle vand, og derfor er reaktionen en kondensation. Det viser sig, at mange vigtige biologiske molekyler sættes sammen ved kondensationsreaktioner, hvor vand afgives. Bagsiden af E.. (1), hvor vand reagerer med et stort molekyle og opdeler det i mindre stykker, kaldes hydrolyse., Ved at udføre hydrolyse kan levende organismer nedbryde molekyler fremstillet af andre arter. De enkle byggesten opnået på denne måde kan derefter rekombineres ved kondensationsreaktioner for at danne strukturer, der passer til deres nye vært.
i modsætning til glyceroltristearatet, der findes i dyr, indeholder vegetabilske fedtstoffer adskillige dobbeltbindinger i deres lange carbonhydridkæder. Denne flerumætning introducerer “kinks” i carbonhydridkæderne på grund af rotationsbarrieren og de 120° vinkler, der er forbundet med dobbeltbindingerne., Derfor er det vanskeligere at justere kæderne side om side (se figur \(\Pageinde. {1}\) ), og de umættede fedtstoffer pakker ikke så let sammen i et krystalgitter. Som det var tilfældet med alkaner, bestemmer kædelængden også, om et fedt er flydende eller fast, og hvor smeltepunktet forekommer.
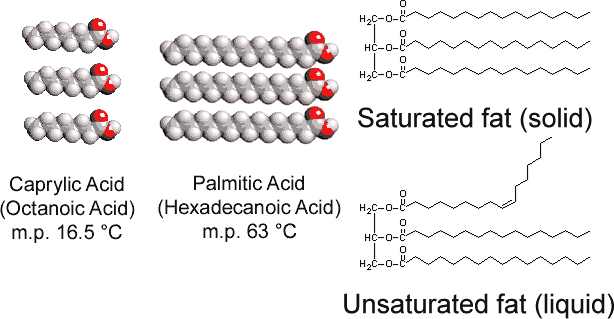
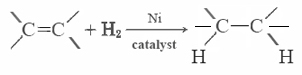
de Fleste umættede fedtstoffer (som majs olie) er væsker ved almindelige temperaturer, mens mættede fedtstoffer (som smør) er faste stoffer. Vegetabilske olier kan omdannes ved hydrogenering til forbindelser, der er faste stoffer. Denne proces indebærer at tilføje H2 katalytisk til dobbeltbindingerne:
hydrolyse af fedtstoffer er vigtig ved fremstilling af sæber., Det kan fremskyndes ved tilsætning af en stærk base som NaOH eller KOH, i hvilket tilfælde reaktionen kaldes forsæbning. Da forsæbning kræver, at reaktionsblandingens pH er høj, vil den producerede fedtsyre dissociere til dens anion. Når glyceroltristearat forsæbes med for eksempel NaOH, dannes natriumstearat, et relativt vandopløseligt stof og en almindelig sæbe.
sæbernes evne til at rense fedt og olie fra snavsede overflader er et resultat af de dobbelte hydrofobe-hydrofile strukturer af deres molekyler., Stearat-ionen består for eksempel af en lang ikke —polær carbonhydridkæde med en meget polær COO– gruppe i den ene ende.
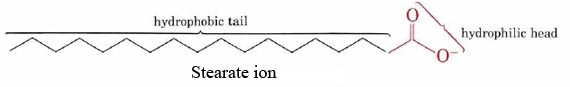
den hydrofobe carbonhydridkæde forsøger at undgå kontakt med vandige medier, mens den anioniske gruppe let rummer dipolattraktioner og hydrogenbindinger af vandmolekyler.
de to vigtigste måder, hvorpå de hydrofobe dele af stearationer kan undgå vand, er at klynge sig sammen på overfladen eller opløses i en lille mængde olie eller fedt (se figur \(\Pageinde. {2}\)).,
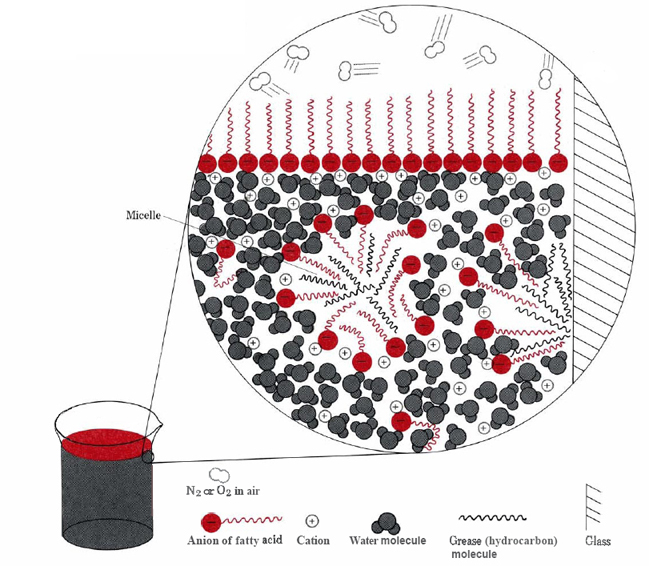
i sidstnævnte tilfælde kommer de hydrofile hoveder af sæbemolekylerne i kontakt med vandet uden for fedtet og danner en struktur kendt som en micelle. Da micellernes ydersider er negativt ladede, afviser de hinanden og forhindrer fedtdråberne i at rekombinere., Fedtet er derfor ophængt (emulgeret) i vandet og kan nemt vaskes væk.
naturlige sæber, såsom natriumstearat, blev oprindeligt fremstillet i hjemmet ved opvarmning af animalsk fedt med træaske, der indeholdt kaliumchlorid, K2CO3. Store mængder produceres stadig industrielt, men i betydelig grad er sæber erstattet af vaskemidler. Dette er en konsekvens af den uønskede opførsel af sæber i hårdt vand. Calcium, magnesium og andre kationer med hårdt vand danner uopløselige forbindelser, når de kombineres med anioner af fedtsyrer., Dette producerer scummy bundfald og forhindrer sæbemolekylerne i at emulgere fedt, medmindre der anvendes et stort overskud.
Rengøringsmidler såsom alkylbenzenesulfonates (ABS) og lineær alkylbenzenesulfonates (LAS) har strukturer, der meget ligner natrium stearat, bortset fra at den opkrævet gruppe i deres hydrofile hoveder er —SO3– knyttet til benzen-ring. ABS-vaskemidler har også methyl (CH3) grupper, der forgrener deres carbonhydridkæder.,
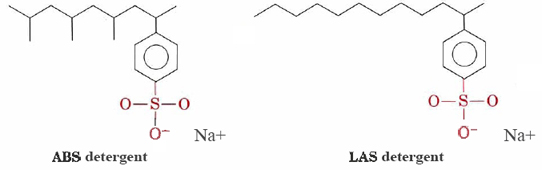
sådanne molekyler udfældes ikke med kationer med hårdt vand og er derfor mere egnede til maskinvask af tøj. LAS-vaskemidlerne erstattede ABS i midten af nitten-tresserne, da det blev opdaget, at sidstnævnte ikke var bionedbrydeligt. De var årsag floder og endda postevand at blive dækket med vaskemiddel skum og skum. Tilsyneladende var en .ymerne i mikroorganismer, der havde udviklet sig til at nedbryde de uforgrenede carbonhydridkæder i naturlige fedtstoffer og fedtsyrer, ikke i stand til at fordøje de forgrenede kæder af ABS-molekyler., LAS-vaskemidler, selvom de fremstilles af mennesker, efterligner strukturerne af naturligt forekommende molekyler og er biologisk nedbrydelige.