Indledning
Elektroner har ingen fast stilling i atomer, stoffer og molekyler (se billedet nedenfor), men har forskellige sandsynligheder for at blive fundet i visse rum (orbitals). Resonansformer illustrerer områder med højere sandsynligheder (elektrondensiteter). Det er som at holde din hat i enten din højre hånd eller din venstre. Udtrykket resonans anvendes, når der er to eller flere muligheder til rådighed., Kemikere bruger Le .is-diagrammer til at skildre struktur og binding af kovalente enheder, såsom molekyler og polyatomiske ioner, fremover molekyler. Le .is-diagrammet for mange molekyler er imidlertid ikke i overensstemmelse med molekylets observerede egenskaber.
Eksempel \(\PageIndex{1}\): Nitrat-Ion
nitrat-ion, i henhold til sine Lewis diagram, har to typer af nitrogen-oxygen-obligationer, én dobbeltbinding, og to enkelt obligationer, hvilket tyder på, at en nitrogen-oxygen bond i nitrat-ion er kortere og stærkere end hvert af de to andre., Le .is-strukturen indebærer også med hensyn til formel ladning, at der er to typer o oxygenygenatomer i nitrationen, en formelt neutral og hver af de to andre med en formel ladning på -1. Eksperimentelt har de tre nitrogen-iltbindinger i nitrationen imidlertid den samme bindingslængde og den samme bindingsenergi, og de tre iltatomer kan ikke skelnes. Le .is-diagrammet undlader at forklare strukturen og bindingen af nitrationen tilfredsstillende.
to yderligere Le .is diagrammer kan tegnes for nitrat-ion.,
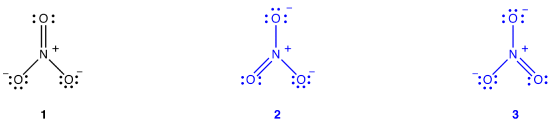
ingen af dem er imidlertid i overensstemmelse med nitrationens observerede egenskaber og afbilder derfor ikke nitrationen korrekt.
Eksempel \(\PageIndex{2}\): Benzen
Benzen, i henhold til sine Lewis diagram, har to typer af carbon-carbon-obligationer, tre dobbeltbindinger og tre indre obligationer, hvilket tyder på, at hver af de tre carbon-carbon-obligationer i benzen er kortere og stærkere end hvert af de tre andre. Eksperimentelt har de seks carbon-carbon-bindinger i ben .en imidlertid den samme bindingslængde og den samme bindingsenergi., Le .is-diagrammet undlader at forklare strukturen og bindingen af ben .en tilfredsstillende.
en egenskab af molekyler, som det klassiske Le .is-diagram ikke er i overensstemmelse med de observerede egenskaber, er, at andre gyldige Le .is-diagrammer kan genereres for dem. Et yderligere Le .is-diagram kan tegnes for ben .en.

imidlertid er ingen af dem i overensstemmelse med de observerede egenskaber af ben .en og afbilder derfor ikke ben .en korrekt.,
Resonans teori er et forsøg på at forklare strukturen af en art, som nitrat-ion eller benzen, ingen Lewis diagram, som er i overensstemmelse med de observerede egenskaber af arter. Den største fordel ved resonans teori er, at selv om Baseret på streng matematisk analyse, resonans teori kan anvendes med succes påberåbe ringe eller ingen matematik. Resonans teori er forklaret nedenfor under anvendelse af nitrat-ion som eksempel.
ifølge resonansteori er nitrationens struktur ikke 1 eller 2 eller 3, men gennemsnittet af alle tre, vægtet efter stabilitet., Lewis diagrammer 1, 2, og 3 kaldes resonans former, resonans strukturer, eller resonans bidragydere af nitrat-ion. Strukturen af nitrat-ionen siges at være en resonanshybrid eller simpelthen hybrid af resonansform 1, 2 og 3. Når det er nødvendigt at vise strukturen af nitrat-ion, resonans former 1, 2 og 3 er tegnet, forbundet med en dobbelthovedet pile.,
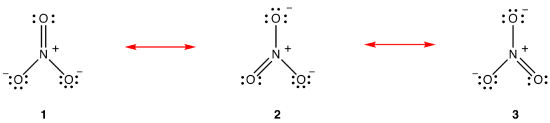
De tre resonans former for nitrat-ion, 1, 2, og 3, er identiske, så de har den samme stabilitet, og derfor ligeledes bidrage til hybrid., Da det præcise omfang, som hver resonans form af nitrat-ion bidrager til den hybrid er kendt, bond for hver nitrogen-oxygen-obligation samt den formelle afgift på hver ilt-atom i den hybride kan let bestemmes:
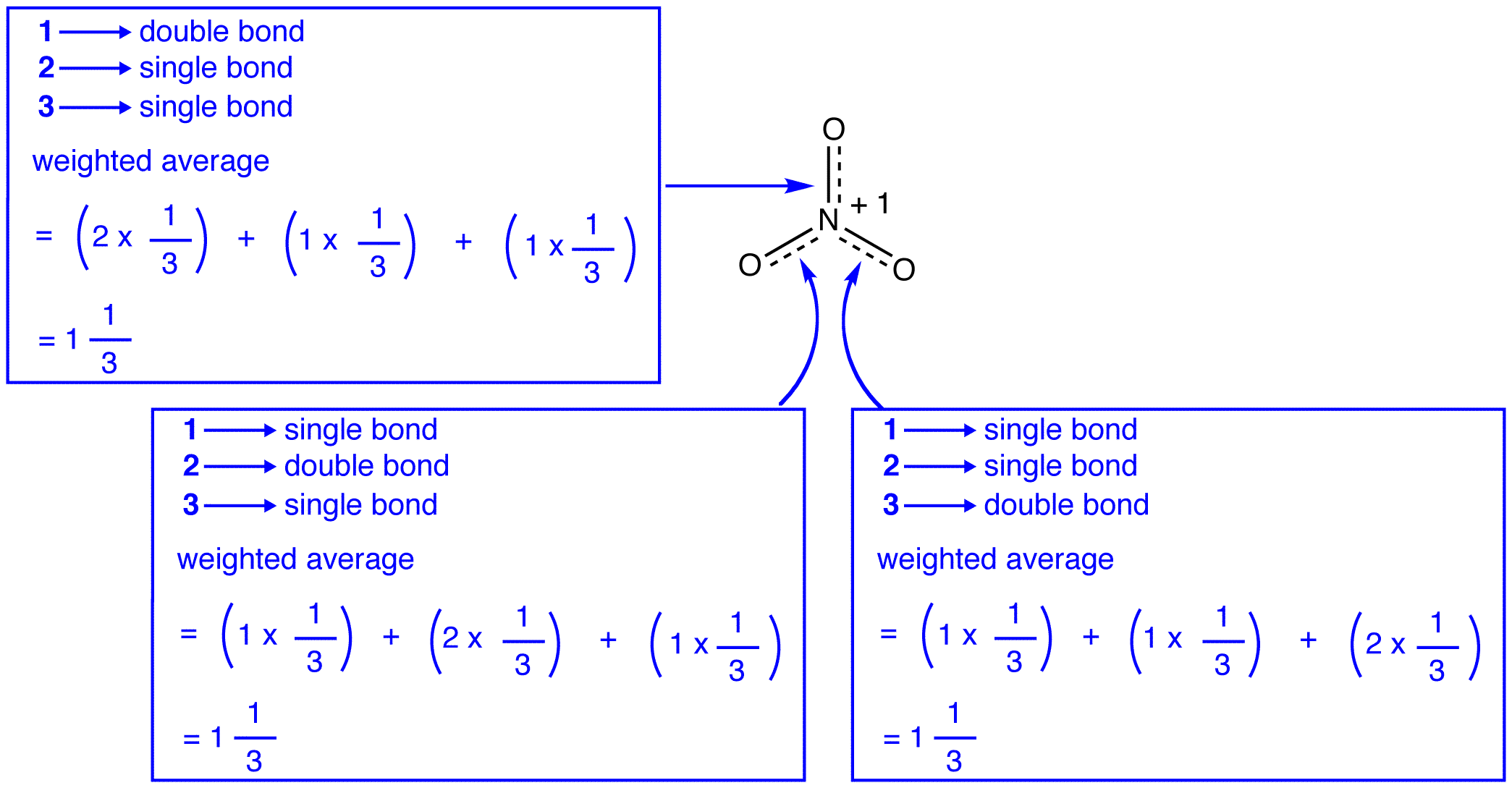
Ifølge for at resonans teori, hver obligation i nitrat-ion er en og en tredjedel af en obligation, hvilket er i overensstemmelse med den iagttagelse, at de tre obligationer i nitrat-ion har den samme obligation længde og samme obligation energi.,
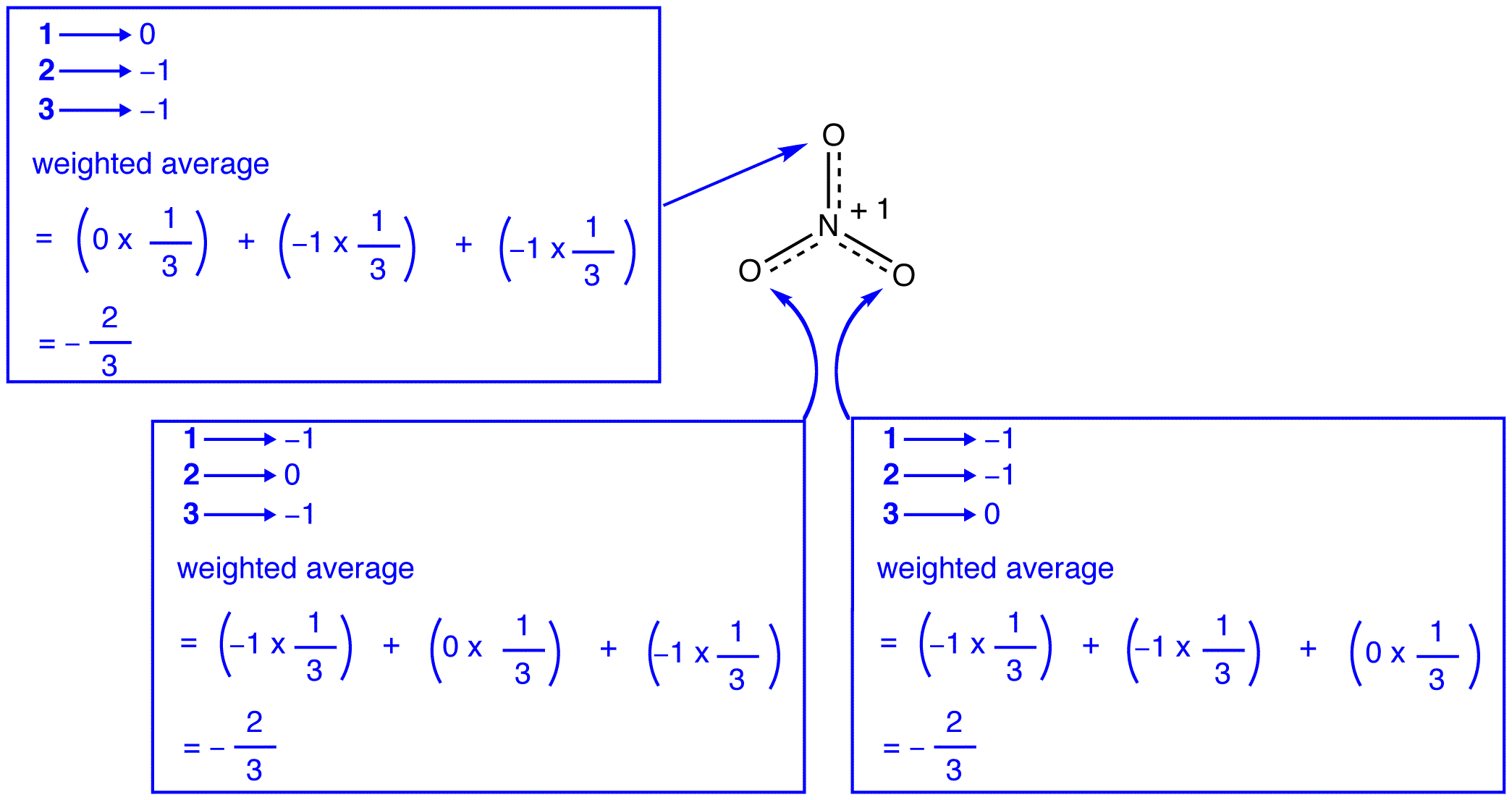
Ifølge for at resonans teori, hver ilt-atom i nitrat-ion har en formel anklage for -2/3, hvilket, sammenholdt med det faktum, at de tre nitrogen-oxygen-obligationer er identiske, er i overensstemmelse med den bemærkning, at tre ilt-atomer i nitrat-ion-kløfter. I hver resonansform af nitration er der to \(\pi\) elektroner, og de deles kun af to atomer. En elektron, der kun deles af to atomer, siges at være lokaliseret., Således er de to \(\pi\) elektroner i hver resonansform af nitrationen lokaliseret. Nitrat-ion, som er repræsenteret ved den hybrid, har to \(\pi\) elektroner:
- # elektroner i en \(\pi\) tykt papir = 2
- # elektroner i en tredjedel af en \(\pi\) tykt papir = 2/3
- # elektroner i tre af dem = 3 x (2/3) = 2
De to \(\pi\) elektroner i nitrat-ion er delt af i alt fire atomer, der er et nitrogen atom og tre ilt-atomer. En elektron, der deles af mere end to atomer, siges at være delokaliseret. Således delokaliseres de to \(\pi\) elektroner i nitrationen., Delokalisering af \(\pi\) elektroner i nitrationen kræver, at de fire atomer er på samme plan, hvilket tillader lateral overlapning af p-orbitalerne på dem.,

Hvis energien af nitrat-ion-var det vejede gennemsnit af de energier af sine tre resonans former, lige som struktur af nitrat-ion-er det vægtede gennemsnit af de strukturer af sine tre resonans former, bør det være lige til energien i en af de tre identiske resonans former:

Hvis energien af hybrid blev svarende til, at en resonans form, i betragtning af, at alle kemiske enheder (elementarpartikler, atomer, molekyler, osv.,) har naturligvis en tendens til at være i den lavest mulige energitilstand, ville der ikke være nogen fordel for nitrationen at eksistere som hybrid; det kunne simpelthen eksistere som en resonansform. Da nitrat-ionen eksisterer som hybrid, ikke som en resonansform, kan det udledes, at hybridens energi er lavere end for nogen af resonansformerne.

ifølge resonansteori er energien i et molekyle lavere end for den laveste energiresonansform., Da nitrationen har lavere energi og derfor er mere stabil end nogen af dens resonansformer, siges nitrationen at være resonanstabiliseret.almindelige misforståelser
Der er to misforståelser om resonansteori blandt begynderstuderende, sandsynligvis på grund af bogstavelig fortolkning af ordet resonans. De beskrives nedenfor ved hjælp af nitrationen som eksemplet.misforståelse 1: nitrat-ionen eksisterer som resonansform 1 et øjeblik og ændres derefter enten til resonansformular 2 eller til resonansformular 3, som interkonverterer eller vender tilbage til 1.,

nitrationens struktur er ikke 1 eller 2 eller 3, men hybriden og ændres ikke med tiden, medmindre den undergår en reaktion.
misforståelse 2: i en prøve af nitrationer findes der på et givet tidspunkt en tredjedel af ionerne som resonansformular 1, en anden tredjedel som resonansformular 2 og den resterende tredjedel som resonansformular 3.

i en prøve af nitrationer har alle ioner på et givet tidspunkt den samme struktur, som er hybrid.,
Muldyr og Næsehorn
klassisk analogi, der bruges til at afklare disse to misforståelser er, muldyr (Morrison, R., T.; Boyd, R.N. Organisk Kemi, femte udgave; Allyn and Bacon: Boston, 1987, pg. 373). Biologisk set er en muldyr en hybrid af en hest og et æsel. Dette betyder ikke, at en muldyr ligner en hest et øjeblik og derefter skifter til at ligne et æsel. Udseendet af en muldyr er en kombination af en hest og et æseles udseende og ændrer sig ikke med tiden. Det betyder heller ikke, at nogle muldyr i en besætning ligner en hest og de andre et æsel., I en besætning har alle muldyr det samme udseende, hvilket er en kombination af en hest og et æsel. Svagheden ved denne analogi er, at heste og Æsler eksisterer, mens resonansformer er strengt hypotetiske. En bedre analogi, citeret i Morrison og Boyd, er næsehornet. Når man så et næsehorn, kunne man beskrive det som hybrid af en drage og en enhjørning, to væsener, der ikke findes.