Úvod
Nukleární faktor kappa B (NF-kB) je starobylé protein, transkripční faktor (Salminen et al., 2008) a považován za regulátora VROZENÉ imunity (Baltimore, 2009). Signální dráha NF-kB spojuje patogenní signály a buněčné nebezpečné signály, čímž organizuje buněčnou rezistenci vůči napadajícím patogenům., Ve skutečnosti, nepřeberné množství studií ukázaly, NF-kB je síťový rozbočovač zodpovědný za komplexní biologické signalizace (Albensi a Mattson, 2000; Kaltschmidt a Kaltschmidt, 2009; Karin, 2009). Za tímto účelem se předpokládá, že NF-kB je hlavním regulátorem evolučně konzervovaných biochemických kaskád (Mattson et al., 2000). Další faktory jsou také translokovány do mitochondrií a podílejí se na modulaci exprese (Barshad et al., 2018a), ale nejsou předmětem tohoto přezkumu., Účelem tohoto přehledu je pokusit se pochopit, jak aktivita NF-kB přispívá k mitochondriální funkci. Předpokládá se, že čtenář již má pochopení základní mitochondriální biologie. V případě další studie, čtenář se odkazuje na mnoho vynikajících studií a recenze na mitochondriální struktury a funkce (Hall, 1979; Fox, 1982; Roger a Silberman, 2002; Wagner a Martin, 2003; Conradt, 2006; Ettema, 2016; Wang a Youle, 2016; Barshad et al., 2018b).,
aktivace NF-kB
podjednotky jaderného faktoru kappa B, které obsahují komplex NF-kB, jsou exprimovány jak v neuronech, tak v gliích. Komplex NF-kB existuje v neaktivním stavu v cytoplazmě (Ghosh et al., 1998; Aggarwal et al., 2004; Hayden a Ghosh, 2004), kde byla dobře popsána aktivace NF-kB (Li a Karin, 2000; Baud a Jacque, 2008; Izrael, 2010). Při stimulaci molekulami, jako je TNFa nebo jiné buněčné stresory, se TNFa váže na receptory TNF (Obrázek 1)., Tato vazba, přes několik mezistupňů, vede k interakci s IkB kinázy (IKK) komplex, který pak vede k fosforylaci IkB, a následně výsledky v IkB ubikvitinace a degradace. Po degradaci se zbývající NF-kB dimer (např. podjednotky p65/p50) přemístí do jádra, kde se váže na DNA konsensuální sekvenci různých cílových genů. Selektivita odpovědi NF-kB je založena na několika faktorech (Sen a Smale, 2010) včetně složení dimeru, načasování a typu buněk., Vliv NF-kB na přežití buněk je také složitý a může být neuroprotektivní nebo prozánětlivý, v závislosti na typu buňky, vývojovém stádiu a patologickém stavu (Qin et al., 2007).
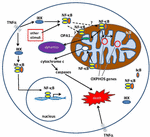
Obrázek 1. Cesty pro signalizaci jaderného faktoru κ B (NF-kB) v cytoplazmě a mitochondrionu. NF-kB Tri-subunt komplex (např. P65, p50, IkB – jedna možná kombinace) existuje v neaktivním stavu v cytoplazmě. Aktivace NF-kB je zahájena, když se molekuly, jako je TNFa, vážou na receptory TNF (existují různé typy)., Jiné vnější nebo vnitřní podněty mohou také aktivovat NF-kB. Komplikovaný převod signálu proces pak začíná, jakmile TNF receptory jsou aktivovány; IkB kinázy (IKK) je vedlo a vede k fosforylaci IkB, což má za následek IkB ubikvitinace a degradace. Jednou IkB degradován, zbývající NF-kB dimery (např. p65/p50 nebo p50/p50 podjednotky kombinace jsou možné) translocates do jádra, kde se váže na DNA konsensus sekvence cílových genů., Procesy, které nejsou dobře pochopeny, mohou NF-kB komplex nebo podjednotky NF-kB také migrovat do mitochondrií, kde to důkazy naznačují/zabírají intermembránový prostor. Jakmile je uvnitř mitochondrií, NF-kB je si myslel, že k interakci s OXPHOS genů (mitochondriální mtDNA), která vede k expresi proteinů zapojených v různých funkcích, včetně mitochondriální dynamiky a COX III nařízení (součást Komplexu IV)., Důkazy také naznačují, že NF-kB může fungovat jako přepínač v mitochondriích a řídit rovnováhu mezi využitím cytoplazmatické glykolýzy a mitochondriálního dýchání v normálních buňkách a v rakovině. A konečně, údaje také poukazují na vnitřní apoptotických cestou stimulace, kde NF-kB aktivace v mitochondriích vede k uvolnění cytochromu c, čímž aktivaci kaspázy kaskády a naprogramované buněčné smrti.,
Organizačně, NF-kB / Rel rodiny transkripční faktor a je spojeno s pěti geny, NF-kB1, NF-kB2, REL, RELB a RELA (Chen a Greene, 2004); tyto geny kódují několik proteinů, NF-kB1, NF-kB2, Rel, RelB a c-Rel, respektive, kde dva z těchto proteinů jsou velké prekurzorové proteiny známé jako p105 a p100, které procházejí proteolýzy, aby se stal p50 a p52, resp. Tyto proteiny obsahují REL-homologické domény (RHD) v jejich amino-terminální oblasti; oblast RHD se skládá ze 2 samostatných, ale sousedních domén., Sekvence nejvzdálenější od karboxy-terminální oblasti umožňuje, aby se protein vázal na DNA. Více interiér sekvence umožňuje Rel rodiny proteinů dimerizovat (homo – nebo heterodimers) pro potlačení projevu prostřednictvím závazných jejich odpovídající rodiny inhibitorů, IkB proteinů (Chen a Greene, 2004). Druhá sekvence zahrnuje sekvenci nukleární lokalizace (NLS), která se odmaskuje, když je IkB nevázána degradací. NLS má za úkol řídit nebo označovat aktivní proteiny pro import do buněčného jádra (Chen a Greene, 2004; Karin et al., 2004; Barger et al.,, 2005).
tři z těchto proteinů (RelA, RelB a c-REL) také kódují transaktivační doménu (TADs) v jejich karboxy-terminální oblasti. V TADs, aby tyto proteiny interagují s bazální transkripční aparát, známý jako TATA binding protein (TBP), Transkripční Faktor, IIB, stejně jako p300 a cAMP response element (CREB) vázající protein (CBP) transkripční ko-aktivátory (Chen a Greene, 2004)., Pouze tyto tři proteiny jsou schopny indukovat transkripci svých oblastí kódujících DNA, zatímco ostatní proteiny, homodimery p50 a p52, jsou schopny obsadit místa vazby DNA bez zahájení transkripce. Vzhledem k tomu působí pozdější 2 homodimerní proteiny P50 a p52 jako transkripční represory (Chen a Greene, 2004).
homodimery P105 a p100 zabírají vazebná místa DNA, čímž blokují transkripci pomocí transkripčních faktorů, které mají TADs (Barger et al., 2005). Třetí forma transkripční represe je způsobena proteiny IkB., Tyto proteiny mají několik ankyrin opakuje jako jejich hlavní domény a funkce vazbou na RHD, které maskují NLS (Karin et al., 2004). Bez aktivní NLS jsou proteiny NF-kB omezeny na cytoplazmu a nejsou schopny migrovat do jádra, a tak je transkripce blokována.
NF-kB se nachází v mitochondriích
v roce 2001, studie Bottero et al. (2001) našel IkBa a podjednotku NF-kB p65 v subcelulárních frakcích a purifikovaných mitochondriích z Jurkatových buněk. Jurkat buňky jsou zvěčněná buněčná linie lidských t lymfocytových buněk, které se používají ke studiu leukémie., V Bottero studie, bylo zjištěno, že IkBa a NF-kB p65 byly lokalizovány v mitochondriální mezimembránového prostoru. Mitochondriální mezimembránového prostoru je prostor, který existuje mezi vnitřní mitochondriální membrána (IMM) a vnější mitochondriální membrány (OMM).
následně, Cogswell et al. (2003) také ukázal, že podjednotky NF-kB, p50 a p65 a IkBa byly nalezeny v mitochondriích. K určení toho bylo použito několik metod k prokázání, včetně elektronové mikroskopie úseků buněk U937., Buňky U937 byly nejprve izolovány z lymfomu mužského pacienta středního věku, aby studovaly chování a diferenciaci monocytů. Zde Cogswell et al. (2003) byl schopen vizualizovat podjednotky NF-kB p50 a p65 a IkBa ve vnitřní matrici mitochondrií. V této studii byly také vyšetřeny jaterní buňky potkanů a identifikovány byly také podjednotky P50 a IkBa. Kromě toho byly buňky U937 stimulovány na 1 h S TNFa, známým spouštěčem signální dráhy NF-kB., V tomto experimentu, Western blot analýzy mitochondriální a cytoplazmatické frakce zjistil, že TNFa léčba způsobila ztrátu IkBa v obou mitochondriální a cytoplazmatické kompartmenty do 30 min po ošetření, což naznačuje, že IkBa byl degradován. EMSA analýzy in vitro test, který detekuje NF-kB aktivace a nespecifické vazby na DNA sekvencí, byla také provedena na protein převzat z jaderné extrakty z mitochondrií izolovaných z buněk U937 stimulovány TNFa., Zde zjistili, že signalizace TNFa vedla ke zvýšené aktivitě vazby DNA NF-kB p50 v proteinu odebraném z mitochondrií.
jiné studie také detekovaly NF-kB v mitochondriích. Patří sem studie (Guseva et al., 2004; Zamora et al., 2004) v lidských fibroblastových buněčných liniích HT1080, lidských prostatických liniích LNCaP a PC3 a buňkách HeLa. V buňkách LNCaP byly nalezeny mitochondrie NF-kB P50 a p65 podjednotky vázané na mitochondriální DNA (mtDNA)., Tyto studie společně ukazují důkazy pro signalizaci NF-kB v mitochondriích a že NF-kB reguluje mitochondriální expresi mRNA (viz část NF-kB a mitochondriální genová exprese níže).
NF-kB Ovládací prvky Mitochondriální Dynamiky
Existuje několik proteinů zapojených v dynamice (štěpení a fúze) a morfologie mitochondrií (Karbowski a Youle, 2003; Olichon et al., 2006; Brooks and Dong, 2007; Song et al., 2008; Autret a Martin, 2010; Silva et al., 2013; Sinha a Manoj, 2019). Jedním z nich je optická atrofie 1 protein (OPA1) (Olichon et al.,, 2006; Garcia et al., 2018; Lee and Yoon, 2018). Studie naznačují, že OPA1 je regulátorem fúze mitochondriální vnitřní membrány a také mitochondriální remodelace cristae (Cipolat et al., 2006). Nedávno Laforge et al. (2016) ukázala, že absence IKKa měla vliv na expresi OPA1 v mitochondriích a na mitochondriální morfologii.
překvapivě v nedávné studii Nan et al. (2017) bylo zjištěno, že stimulace TNFa receptoru 2 (tnfr2) podporuje mitochondriální fúzi prostřednictvím NF-kB závislé aktivace exprese OPA1 v srdečních myocytech., Důležité je, že aktivace TNFR2 v této studii chránila srdeční myocyty před stresem upregulací exprese OPA1. Podáváním nízkých koncentrací exogenní TNFa (0,5 ng / mL) před ischemií-reperfuze se zdálo, že zvyšuje přežití buněk, zatímco vyšší koncentrace (10-20 ng/mL) vedly k toxickým účinkům v buňkách.
NF-kB a apoptóza v mitochondriích
role mitochondrií v programované buněčné smrti nebo apoptóze je známa již delší dobu (Green and Reed, 1998; Wang and Chen, 2015)., Nejdůležitější úlohou mitochondrií je generování ATP; druhou nejdůležitější funkcí pro mitochondrie je však pravděpodobně kontrola buněčné smrti. Jak to dělá mitochondrion? Pokud mitochondrion selže při vyvolání buněčné smrti, rakovina je často důsledkem. Aby bylo možné regulovat buněčnou smrt, mitochondrie integrují signály z různých zdrojů, které jsou známé jako vnitřní cesty apoptózy. Komponenty aktivity NF-kB se zdají být jedním z těchto signálů, ačkoli TNFa, aktivátor NF-kB, je součástí vnější dráhy apoptózy., Vnější cesty (zprostředkované death receptor) jsou iniciovány mimo buňku, zatímco vnitřní cesty apoptózy jsou zprostředkovány a spouštěny v mitochondriích.
v nedávné studii pazarentzos et al. (2014) bylo zjištěno, že IkBa vykazuje proapoptotickou aktivitu, protože inhibuje ANTIAPOPTOTICKOU NF-kB. Ve většině buněk vede aktivace NF-kB k následné expresi cílového genu, která vyvolává rezistenci na buněčnou smrt (Luo et al., 2005). V této studii bylo prokázáno, že nová funkce apoptózy byla způsobena IkBa, podjednotkou, která inhibuje aktivaci NF-kB. Pazarentzos et al., (2014) zjistili, že IkBa lokalizuje na OMM kde interaguje s napětím závislý aniontový kanál (VDAC) a mitochondriální hexokinázu II (HKII) ke stabilizaci tohoto komplexu a zabránit Bax-zprostředkované uvolnění cytochromu c pro apoptózu. Bax je členem rodiny proteinů Bcl – 2, které byly prokázány jako regulátory programované buněčné smrti (Karbowski et al., 2006).
jiné studie také naznačily roli NF-kB při přímé regulaci apoptózy v mitochondrionu. Ve studii Liu et al., (2004), inhibice NF-kB sama v makrofázích za následek uvolnění cytochromu c. Připomeňme, že cytochrom c je zodpovědný za pendluje elektrony z Komplexu III na Komplex IV a uvolnění cytochromu c do cytoplazmy, což activator of caspases, je klíčovým krokem v aktivaci apoptózy.
NF-kB a mitochondriální dýchání
jaderný faktor kappa B byl prokázán v mnoha studiích na podporu tumorigeneze. Jak k tomu došlo, nebylo úplně jasné. V průkopnické studii Mauro et al., (2011) bylo zjištěno, že NF-kB upreguluje mitochondriální dýchání v buňkách karcinomu tlustého střeva. Zde zjistili, že tato funkce NF-kB potlačuje Warburgův efekt. Připomeňme, že Warburg efekt (Vander Heiden et al., 2009) popisuje pozorování, že rakovinné buňky mají tendenci upřednostňovat metabolismus glykolýza, spíše než více efektivní oxidativní fosforylace cestou. Takže v této studii autoři zjistili, že NF-kB organizuje sítě energetického metabolismu kontrolou rovnováhy mezi využitím glykolýzy a mitochondriálním dýcháním., Zajímavé je, že našli roli pro NF-kB v metabolické adaptaci v normálních buňkách a v rakovině. Jejich výsledky dále naznačovaly, že potlačení mitochondriálního metabolismu v zavedených rakovinných buňkách inhibicí NF-kB a metforminu snižuje tumorigenezi.
NF-kB a mitochondriální genová exprese
jaderný faktor kappa B je známým regulátorem genové exprese-negativně i pozitivně (Mattson et al., 2000). Nicméně, jak NF-kB reguluje nebo ovlivňuje nukleárně kódovanou mitochondriální genovou expresi, je méně pochopeno., Lidská mtDNA má 37 genů, které kódují 13 polypeptidů. Bylo prokázáno, že geny mtDNA kódují mnoho podjednotek všech 5 komplexů elektronového transportního řetězce (ETC), 2 rRNA a 22 tRNA. Většina podjednotek ETC je kódována jadernou DNA, která by mohla být ovlivněna aktivitou NF-kB (Calvo et al., 2016).
například to bylo nárokováno (Cogswell et al., 2003), že cesta NF-kB může negativně regulovat mitochondriální genovou expresi spojenou s podjednokou COX III., Podjednotka COX III je kódována mtDNA a je součástí komplexu IV v mitochondriálních atd. Funguje jako katalytická podjednotka v komplexu IV, což je komplex spojený se spotřebou mitochondriálního kyslíku. Ve studii Cogswell et al. (2003), modulace aktivace NF-kB vedla ke ztrátě exprese jak Cox III, tak cytochromu b mRNA. Další studie podporují roli pro NF-kB reguluje další mitochondriální geny, jako je COX já, a Cytb (Psarra a Sekeris, 2008, 2009; Barshad et al., 2018b)., Navíc podjednotka NF-kB p65 snížila hladiny CytB mRNA kódované mtDNA, případně vazbou na D-smyčku v lidských buňkách v nepřítomnosti p53(Johnson et al ., 2011). Celkově tyto výsledky naznačují, že signalizace NF-kB může ovlivnit enzymatickou aktivitu respiračních atd. komplexů.
NF-kB Zprostředkovává Aß Indukované Dysfunkce v Mitochondriích
Alzheimerova nemoc (AD) je spojeno s build-up Aß plaků a/nebo vzhled neurofibrilární klubka (NFTs) v určitých oblastech mozku (Duyckaerts et al., 2009)., Existuje však diskuse o tom, zda Aß je původcem AD nebo zda Aß jednoduše koreluje se stárnutím. Akumulační důkazy (Aliev et al., 2009; Correia et al., 2012; Cadonic et al., 2016; Cardoso et al., 2017; Djordjevic et al., 2017) také poukazuje na změny v metabolismu mozku řízen mitochondriální dysfunkce jako proces centrální mnoha věkem související neurodegenerativní onemocnění včetně AD. Přidání k tomu důkazy, tam jsou také postižení enzymatické aktivity proteinu komplexů ATD a změny v antioxidační enzymatické aktivity (Kolosova et al.,, 2017) v inzerátu. Zejména se ukázalo, že komplexní IV aktivita je negativně ovlivněna v AD (Mutisya et al., 1994).
v nedávné studii Shi et al. (2014) bylo zjištěno, že Aß zhoršila mitochondriální funkci prostřednictvím signalizace NF-kB. Navíc, Shi et al. (2014) zde ukázal, že Aß snížil expresi podjednotky COX III cestou NF-kB., Důležité je, aby se vyloučila možnost, že IkBa byl fosforylován Aß v cytoplazmě (a pak transportován do mitochondrií), izolované mitochondrie byly inkubovány s Aß v přítomnosti (nebo nepřítomnosti) NF-kB blocker, a to BAY11-7082. Zde našli indukovanou fosforylaci a degradaci Ikby v izolovaných mitochondriích.
tato zjištění mají také důležité důsledky pro léčbu AD, jak dokazují nedávné studie Snow et al. (2018) a jak je ukázáno v dalších souvisejících studiích (Djordjevic et al., 2017; Adlimoghaddam et al.,, 2019), které naznačují, že zaměření signalizace NF-kB v mitochondriích může mít terapeutickou hodnotu. Například ve sněhu a kol.’s studie, kreatin – známý modulátor mitochondriální funkce (Tarnopolsky a Beal, 2001), bylo prokázáno, že zvýšení a pozitivně změnit hladiny proteinů CaMKII, PSD-95 a Komplexní 1 podjednotek v kreatin krmených myší, vzhledem k tomu, že NF-kB inhibiční IkB podjednotky byla snížena. Pro další čtení na kreatin je potenciální terapeutický účinek na mitochondriální funkce a mitochondriální poruchy nebo jiné neurologické poruchy viz studie a recenze Matthews et al., (1998), Klivenyi et al. (1999), Tarnopolsky a Beal (2001), Hersch et al. (2006), Rodriguez et al. (2007) a Beal (2011).
Role NF-kB v zánětu a mitochondriálním metabolismu
zvyšující se data (Lamas et al., 2003; Mauro et al., 2011; Moretti et al., 2012) naznačují, že signalizace NF-kB, která je mediátorem zánětlivých procesů, funguje také jako regulátor a integrátor s energetickým metabolismem. V nedávné studii Zhong et al. (2016) bylo prokázáno, že NF-kB omezuje aktivaci inflamasomu eliminací poškozených mitochondrií., Překvapivě, NF-kB se objevil na obou prime NLRP-3 inflammasome pro aktivaci a také zabránit nadměrnému zánětu a zdrženlivý NLRP-3 inflammasome aktivace; i když mechanismus pro omezení bylo špatně definované. Zde se spekulovalo, že kromě toho, že NF-kB je aktivátorem zánětlivých genů, fungovala také v této studii omezením aktivace nlrp3 inflamasome a produkce IL-1β. Navíc bylo zjištěno, že indukce p62 byla zodpovědná za inhibiční aktivitu inflamasomu NF-kB., Zdá se, že NF-kB může omezit jeho vlastní zánětu v makrofázích podporou p62 zprostředkované odstranění poškozených mitochondrií (mitophagy) po makrofágy komunikovat s různými NLRP3 inflammasome aktivátory.
závěr
před více než 10 lety byl v mitochondriích zjištěn NF-kB. Překvapivě, pro tak důležitý transkripční faktor, byl učiněn malý pokrok při odhalování specifických rolí pro NF-kB ovlivňujících mitochondrion., Některé studie, jak je popsáno výše, poskytují důkazy o NF-kB v mitochondriální dynamice, apoptóze, respirační kontrole, genové expresi a mechanismech onemocnění (Obrázek 1). Duplikace těchto výsledků a celková validace je však stále nezbytná jinými laboratořemi. Nějaké další vhled může být sbíráno ze skutečnosti, že jiné transkripční faktory s účinky na jaderné geny, jako například AP-1, p53, CREB, c-Myc, Wnt13, Dok-4, HMGA1, a c-Src byly také detekovány v mitochondriích (Psarra a Sekeris, 2008)., Zajímavé je, že vazebných míst v mitochondriálním genomu (homologní k jejich vazebných míst v jaderné DNA) pro některé z těchto faktorů byly určeny (Psarra a Sekeris, 2008), kde role pro mitochondriální transkripce a apoptózy jsou podezřelé a ukázat některé celkový vzory aktivity. Například, argument může být, že některé z těchto faktorů (NF-kB, CREB a AP-1) se váží na mitochondriálních genomů a většinou tlumí mitochondriální genové exprese (Blumberg et al., 2014), přičemž má stimulační účinky na transkripci jaderných genů., Však jasně že je potřeba pracovat nejen najít přesné role, činnosti, ale také k určení, pokud celková vzory činnosti skutečně existují.
Po průzkumu této literatury, je také zřejmé, že NF-kB roli v regulaci mitochondriální dýchání má hluboké důsledky a ukazuje, úroveň složitosti, ne dříve ocenil. Například Mauro et al. (2011) údaje určují roli NF-kB v metabolické adaptaci v normálních buňkách a v rakovině a také naznačují důsledky pro jiné stavy onemocnění, jako je AD., Kromě toho, vzhledem k tomu, že NF-kB může omezit svůj vlastní zánět, jak ukazuje Zhong et al. (2016) je nejen překvapující, ale dále ilustruje složitost signalizace NF-kB v mitochondriální funkci.
v tomto přehledu byly zkoumány studie o úloze NF-kB v mitochondriální funkci a zdá se, že výzkum v této oblasti roste. Komplikující výsledky je však pozorování, že v mitochondriální funkci hraje podobnou roli více faktorů, a proto jsou nezbytné podrobné studie specifické pro každý faktor., Na závěr můžeme znovu položit otázku – co dělá NF-kB v mitochondriích a mitochondriích? Okamžitá a zkrácená odpověď by byla-hodně!
autorské příspěvky
autor vytvořil Téma a napsal rukopis.
finanční Prostředky
Tato práce byla podpořena prostředky z Kanadských Institutes of Health Research (CIHR), Kanadské Zemědělské Partnerství (SZP), St. Boniface Hospital Research Foundation, Alzheimer Society of Manitoba, Výzkum Manitoba, Vážení Douglas a Patricia Everett, a Royal Canadian Properties Limited Nadačního Fondu.,
Prohlášení o střetu zájmů
autor prohlašuje, že výzkum byl proveden bez jakýchkoli obchodních nebo finančních vztahů, které by mohly být chápány jako potenciální střet zájmů.
poděkování
autor by rád poděkoval Dr. Grantovi Hatchovi za recenzi rukopisu.
Hayden, M. S. a Ghosh, S. (2004). Signalizace NF-kappaB. Geny Dev. 18, 2195–2224.
PubMed Abstraktní | Google Scholar
Wang, X. Chen, X. J. (2015)., Cytosolická síť potlačující proteostatický stres zprostředkovaný mitochondriemi a buněčnou smrt. Nature 524, 481-484. doi: 10.1038 / nature14859
PubMed Abstract / CrossRef Full Text / Google Scholar