Cíle Vzdělávání
- Definovat korozi
- Seznam některých použitých metod, aby se zabránilo nebo zpomalit korozi
Koroze je obvykle definována jako degradace kovů v důsledku elektrochemických procesů. Tvorba rzi na železe, pošpinění na stříbře a modrozelená patina, která se vyvíjí na mědi, jsou všechny příklady koroze., Celkové náklady na korozi ve Spojených státech jsou významné, přičemž odhady přesahují půl bilionu dolarů ročně.
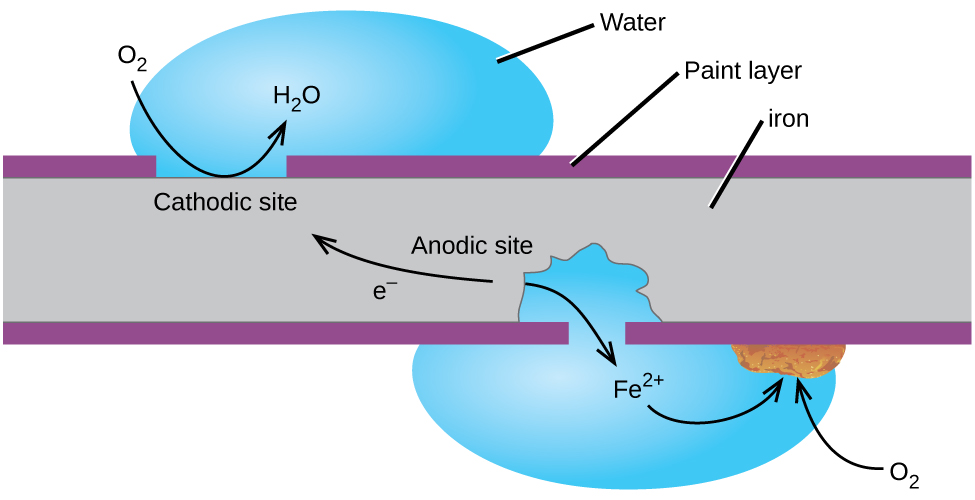
snad nejznámějším příkladem koroze je tvorba rzi na železo. Železo bude rez, když je vystaveno kyslíku a vodě. Zdá se, že hlavní kroky v rezivění železa zahrnují následující (obrázek 2). Jakmile je železo vystaveno atmosféře, rychle oxiduje.
elektrony redukují kyslík ve vzduchu v kyselých roztocích.
to, Co nazýváme rez je hydratovaná železo(III) oxid, který se tvoří, když železo(II) ionty dále reagovat s kyslíkem.,
počet molekul vody je variabilní, takže je reprezentován x. Na rozdíl od patiny na měď, tvorba rez nevytváří ochrannou vrstvu a tak korozi železa pokračuje jako rez odpadává a odhaluje svěží železa do atmosféry.
Jeden způsob, jak udržet železo před korozí je, aby to maloval. Vrstva barvy zabraňuje kontaktu vody a kyslíku potřebného pro tvorbu rzi se železem. Dokud barva zůstane neporušená, žehlička je chráněna před korozí.,
další strategie zahrnují legování železa s jinými kovy. Například nerezová ocel je většinou železo s trochou Chromu. Chrom má tendenci se shromažďovat v blízkosti povrchu, kde tvoří oxidovou vrstvu, která chrání železo.
pozinkované nebo pozinkované železo používá jinou strategii. Zinek je snadněji oxidován než železo, protože zinek má nižší redukční potenciál. Vzhledem k tomu, že zinek má nižší redukční potenciál, je to aktivnější kov. Takže i když je zinkový povlak poškrábaný, zinek se ještě oxiduje před železem., To naznačuje, že tento přístup by měl pracovat s jinými aktivními kovy.
dalším důležitým způsobem ochrany kovu je vytvoření katody v galvanické buňce. To je katodická ochrana a může být použita pro jiné kovy než jen železo. Například rezivění podzemních zásobníků železa a trubek lze zabránit nebo výrazně snížit jejich připojením k aktivnějšímu kovu, jako je zinek nebo hořčík (obrázek 3). To se také používá k ochraně kovových částí v ohřívačích vody., Aktivnější kovy (nižší redukční potenciál) se nazývají obětní anody, protože jak se zvyknou, když korodují (oxidují) na anodě. Kov, který je chráněn, slouží jako katoda, a tak neoxiduje (koroduje). Když jsou anody řádně monitorovány a pravidelně vyměňovány, může být životnost zásobníku železa značně prodloužena.
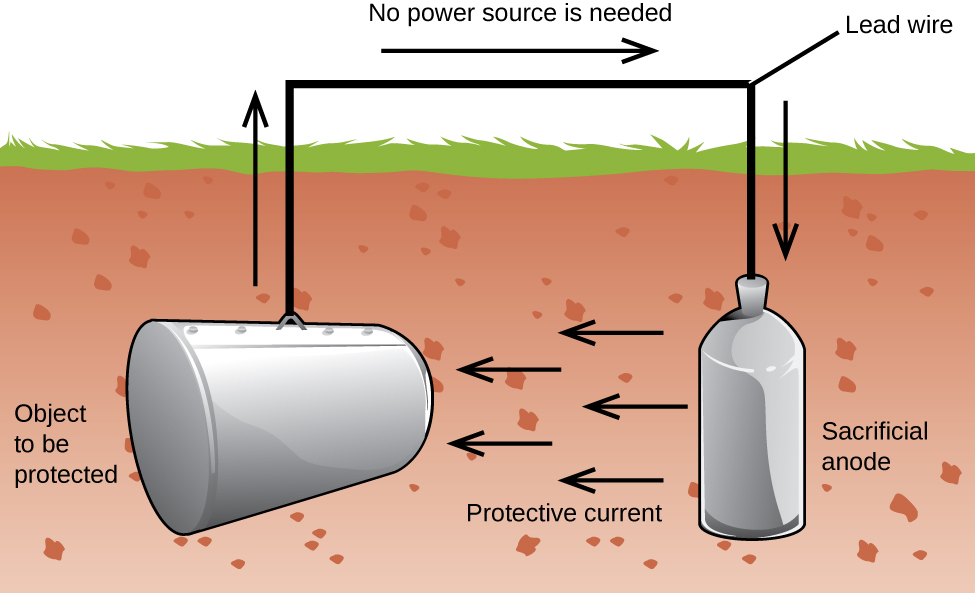
Koroze je degradace kovu způsobena elektrochemický proces. Velké sumy peněz se vynakládají každý rok na opravu účinků nebo prevenci koroze. Některé kovy, jako je hliník a měď, vytvářejí ochrannou vrstvu, když korodují ve vzduchu., Tenká vrstva, která se tvoří na povrchu kovu, zabraňuje kontaktu kyslíku s více atomy kovu, a tak „chrání“ zbývající kov před další korozí. Železo koroduje (vytváří rez), když je vystaveno vodě a kyslíku. Rez, který se tvoří na železných kovových vločkách, vystavuje čerstvý kov, který také koroduje. Jedním ze způsobů, jak zabránit nebo zpomalit korozi, je potahování kovu. Povlak zabraňuje kontaktu vody a kyslíku s kovem. Barva nebo jiné povlaky zpomalí korozi, ale nejsou účinné, jakmile jsou poškrábány., Pozinkované nebo pozinkované železo využívá skutečnosti, že zinek je pravděpodobnější, že oxiduje než železo. Dokud povlak zůstane, i když je poškrábaný, zinek se oxiduje před železem. Další metodou ochrany kovů je katodická ochrana. Při této metodě je snadno oxidovaný a levný kov, často zinek nebo hořčík (obětní anoda), elektricky spojen s kovem, který musí být chráněn. Aktivnější kov je obětní anoda a je anodou v galvanické buňce. „Chráněný“ kov je katoda a zůstává neoxidovaný., Jednou z výhod katodické ochrany je, že obětní anoda může být v případě potřeby monitorována a vyměněna.,
Slovníček pojmů
katodové ochrany způsob ochrany kovů pomocí obětní anoda a fakticky kov, který potřebuje ochranu katodě, čímž se zabrání její oxidaci, korozi, degradaci kovu prostřednictvím elektrochemického procesu, pozinkovaného metodou pro ochranu železa tím, že pokryje ji s zinek, který bude oxidovat, než železa; zinek-pokovené železo obětní anoda více aktivní, levné kovové používány jako anod v katodické ochrany; často vyrobené z hořčíku nebo zinku
Řešení
Odpovědi na Chemii Konci Kapitoly Cvičení
2., Mg a Zn
4. Oba příklady zahrnují katodickou ochranu. (Obětní) anoda je kov, který koroduje (oxiduje nebo reaguje). V případě železa (-0.447 V) A zinku (-0.7618 V) má zinek zápornější standardní redukční potenciál, a tak slouží jako anoda. V případě železa a mědi (0,34 V) má železo menší standardní redukční potenciál a tak koroduje (slouží jako anoda).
6., Zatímco redukční potenciál lithia by byl schopen chránit ostatní kovy, tento vysoký potenciál také svědčí o tom, jak reaktivní lithium je; u většiny látek by to mělo spontánní reakci. To znamená, že lithium by rychle reagovalo s jinými látkami, dokonce i těmi, které by neoxidovaly kov, který se pokouší chránit. Reaktivita, jako je tato, znamená, že obětní anoda by byla rychle vyčerpána a je třeba ji často vyměňovat. (Volitelný další důvod: nebezpečí požáru v přítomnosti vody.)