Brønsted-Lowryho Teorie Kyselin a Bází
Brønsted-Lowryho teorie kyselin a bází vzal Arrheniovy definice ještě o krok dále, jako látka již není potřeba být složen z vodíku (H+) nebo hydroxidu sodného (OH-) ionty, aby byla klasifikována jako kyseliny nebo báze. Pro exmapl zvažte následující chemickou rovnici:
\
- a Brønsted-Lowry acid je donor protonu (vodíkového iontu).
- Brønsted-Lowry báze je akceptor protonu (vodíkových iontů).,
v této teorii je kyselina látkou, která může uvolnit proton (jako v teorii Arrhenius) a báze je látka, která může přijmout proton., Základní soli, jako jsou Na+, F-, generuje ionty OH – ve vodě tím, že protony z vody sám (HF):
\
- disociace Kyseliny
\
- Kyselina Ionizační Konstanta:
\}{}\]
- Základní disociace:
\
- Základní Ionizační Konstanta
\}{}\]
stanovení látky jako Brønsted-Lowery kyseliny nebo báze může být provedeno pouze tím, že sleduje reakce. V případě HOH je to báze v prvním případě a kyselina ve druhém případě.,
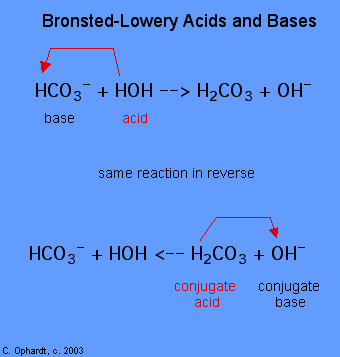
k určení, zda je látka kyselinou nebo bází, počítejte vodíky na každé látce před a po reakci. Pokud se počet hydrogenů snížil, je to kyselina (daruje vodíkové ionty). Pokud se počet hydrogenů zvýšil, je tato látka základem (přijímá vodíkové ionty). Tyto definice se obvykle aplikují na reaktanty vlevo. Pokud je reakce zobrazena obráceně, může být identifikována nová kyselina a báze., Látky na pravé straně rovnice se nazývají konjugovaná kyselina a konjugovaná báze ve srovnání s látkami vlevo. Všimněte si také, že původní kyselina se po ukončení reakce změní v konjugované bázi.
Poznámka:
Kyseliny jsou Proton Dárce a Základny jsou Proton Akceptory
reakce na to, být v rovnováze přenos elektronů musí dojít. Kyselina dá elektron pryč a základna obdrží elektron. Kyseliny a báze, které spolupracují tímto způsobem, se nazývají konjugovaný pár tvořený konjugovanými kyselinami a konjugovanými bázemi.,
\
a znamená kyselou sloučeninu A Z znamená základní sloučeninu
- a daruje H za vzniku HZ+.
- Přijímá Z H, z, které tvoří HZ+
- – se stává konjugovaná báze HA a v reverzní reakce, přijímá H z HZ obnovit HA s cílem, aby zůstaly v rovnováze
- HZ+ se stává konjugovaná kyselina Z a v reverzní reakce, to daruje H A – obnovovat Z v, aby zůstal v rovnováze