Vztah mezi Tlakem a Objemem: boyleův Zákon
Jako tlak na plyn, zvyšuje se objem plynu zmenší, protože částice plynu jsou nuceni blíže k sobě. Naopak, jak tlak na plyn klesá, objem plynu se zvyšuje, protože částice plynu se nyní mohou pohybovat dále od sebe., Meteorologické balóny získat větší, jak oni se zvednou přes atmosféru do oblastí nižšího tlaku, protože objem plynu se zvýšila, to znamená, atmosférický plyn má menší tlak na povrchu balónu, takže interiér plyn expanduje, dokud se vnitřní a vnější tlaky jsou stejné.
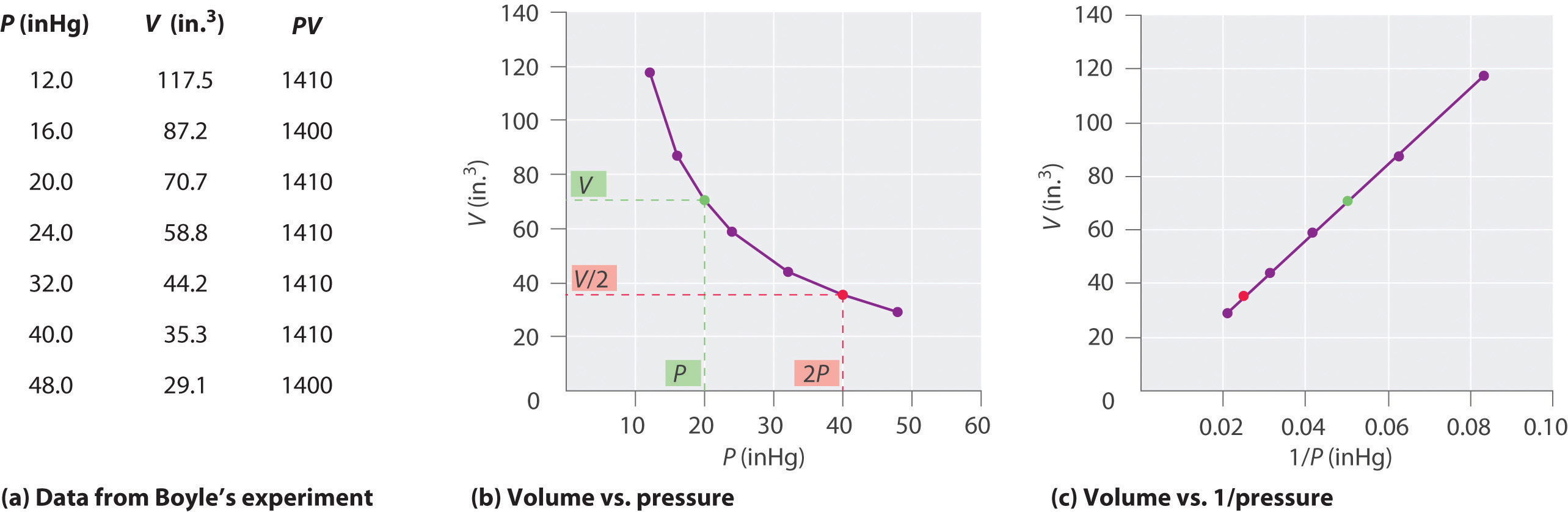
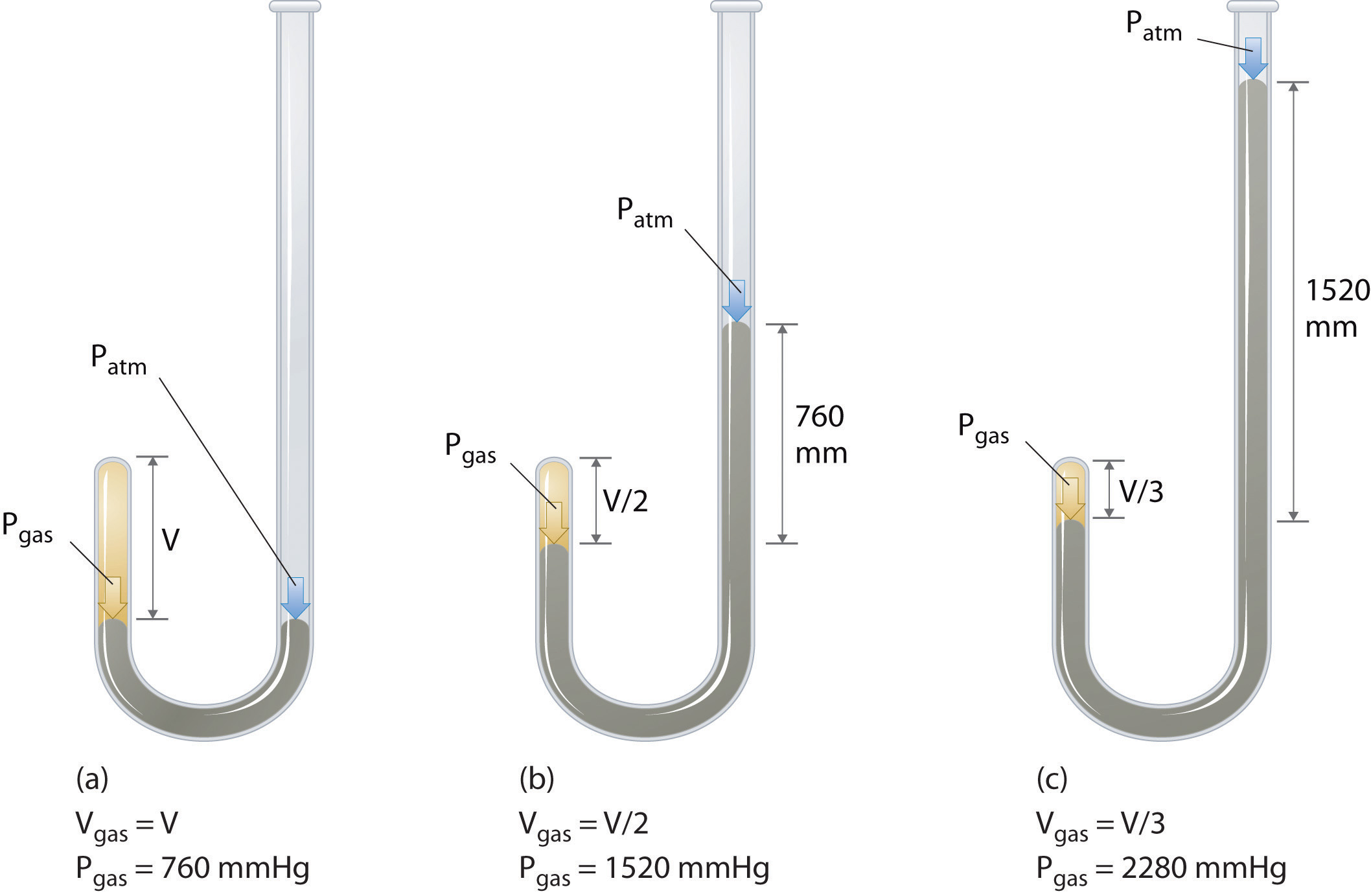
Irský chemik Robert Boyle (1627-1691) se provádí některé z prvních experimentů, které určí kvantitativní vztah mezi tlakem a objemem plynu. Boyle použil trubici ve tvaru J částečně naplněnou rtutí, jak je znázorněno na obrázku \(\PageIndex{1}\)., V těchto experimentech, malé množství plynu nebo vzduchu je v pasti výše rtuťového sloupce, a jeho objem se měří za atmosférického tlaku a konstantní teplotě. Do otevřeného ramene se pak nalije více rtuti, aby se zvýšil tlak na vzorek plynu. Tlak na plyn je atmosférický tlak plus rozdíl ve výškách rtuťových sloupců a výsledný objem se měří. Tento proces se opakuje, dokud buď není v otevřeném rameni více místa, nebo je objem plynu příliš malý na to, aby byl měřen přesně., Data, jako jsou Data z jednoho z Boyleových vlastních experimentů, mohou být vykreslena několika způsoby (obrázek \(\PageIndex{2}\)). Jednoduchý graf \(v\) versus \(P\) dává křivku zvanou hyperbola a odhaluje inverzní vztah mezi tlakem a objemem: když se tlak zdvojnásobí, objem se sníží o faktor dva. Tento vztah mezi dvěma veličinami je popsán takto:
\
Dělení obě strany rovnice \(P\) dává rovnici ilustrující inverzní vztah mezi \(P\) a \(V\):
\
nebo
\
kde ∝ symbol je číst „, je úměrná.“Děj V versus 1 / P je tedy přímka, jejíž sklon se rovná konstantě v rovnici 6.2.1 a rovnici 6.2.3. Dělení obou stran rovnice 6.2.1 V namísto P dává podobný vztah mezi P a 1 / v., Číselná hodnota konstanty závisí na množství plynu použitého v experimentu a na teplotě, při které se experimenty provádějí. Tento vztah mezi tlakem a objemem, je známý jako boyleův zákon, po jeho objevitel, a lze konstatovat následující: Při konstantní teplotě, objemu pevné množství plynu je nepřímo úměrný jeho tlaku.