Úvod
Elektrony nemají pevnou pozici ve atomů, sloučenin a molekul (viz obrázek níže), ale pravděpodobnost, že našel v určitých prostorech (orbitaly). Rezonanční formy ilustrují oblasti vyšších pravděpodobností (elektronové hustoty). Je to jako držet klobouk buď v pravé ruce, nebo vlevo. Termín rezonance se používá, pokud jsou k dispozici dvě nebo více možností., Chemici použití Lewis diagramy znázorňují strukturu a vazby kovalentní subjekty, jako jsou molekuly a iontů polyatomic, od nynějška, molekuly. Lewisův diagram mnoha molekul však není v souladu s pozorovanými vlastnostmi molekuly.
Například \(\PageIndex{1}\): Amonného Iontu,
amonného iontu, podle jeho Lewis diagram, má dva druhy dusíku a kyslíku dluhopisů, jednu dvojnou vazbu a dvě jednoduché vazby, což naznačuje, že jeden dusík-kyslík dluhopisů v dusičnanového iontu je kratší a silnější, než každé z dalších dvou., Také Lewis struktura znamená, s ohledem na formální obvinění, že existují dva typy atomů kyslíku v amonného iontu, jeden formálně neutrální, a každý z dalších dvou nesoucí formální náboj -1. Experimentálně však tři vazby dusíku a kyslíku v dusičnanovém iontu mají stejnou délku vazby a stejnou energii vazby a tři atomy kyslíku jsou nerozeznatelné. Lewisův diagram uspokojivě nevysvětluje strukturu a vazbu dusičnanového iontu.
pro dusičnanový iont lze nakreslit dva další Lewisovy diagramy.,
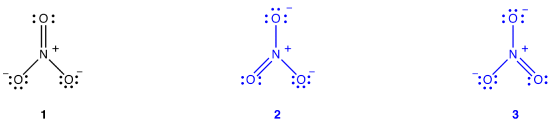
Nicméně, žádný z nich jsou konzistentní s pozorovanými vlastnostmi amonného iontu, a proto není správně líčit amonného iontu.
Například \(\PageIndex{2}\): Benzen
Benzen, podle jeho Lewis diagram, má dva typy uhlík-uhlík, tři dvojné vazby a tři samostatné dluhopisy, což naznačuje, že každý ze tří uhlík-uhlík v benzenu je kratší a silnější, než každý z ostatních tří. Experimentálně však šest uhlíkových a uhlíkových vazeb v benzenu má stejnou délku vazby a stejnou energii vazby., Lewisův diagram uspokojivě nevysvětluje strukturu a vazbu benzenu.
atribut molekuly, které klasické Lewis diagram není v souladu s pozorovanou vlastností je, že ostatní platné Lewis diagramy mohou být generovány pro ně. Pro benzen lze nakreslit další Lewisův diagram.

Nicméně, žádný z nich jsou v souladu s pozorovanými vlastnosti benzenu, a proto není správně znázornit benzen.,
Rezonanční teorie je pokusem vysvětlit strukturu druhů, jako dusičnanového iontu nebo benzen, ne Lewis diagram, který je konzistentní s pozorovanými vlastnostmi druhů. Hlavní výhodou rezonanční teorie je, že i když na základě přísné matematické analýzy lze teorii rezonance úspěšně aplikovat na malou nebo žádnou matematiku. Rezonanční teorie je vysvětlena níže pomocí dusičnanového iontu jako příkladu.
podle rezonanční teorie není struktura dusičnanového iontu 1 ani 2 ani 3, ale průměr všech tří z nich vážený stabilitou., Lewisovy diagramy 1, 2 a 3 se nazývají rezonanční formy, rezonanční struktury nebo rezonanční přispěvatelé dusičnanového iontu. Struktura dusičnanového iontu je považována za rezonanční hybrid nebo jednoduše hybrid rezonančních forem 1, 2 a 3. Kdykoli je třeba ukázat strukturu dusičnanového iontu, jsou kresleny rezonanční formy 1, 2 a 3, spojené dvojhlavými šipkami.,
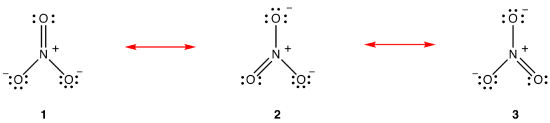
tři rezonanční formy amonného iontu, 1, 2, a 3 jsou totožné, takže mají stejnou stabilitu, a proto přispívají k hybridní., Od té přesné míry, do jaké každý rezonance formě amonného iontu přispívá k hybrid je známo, dluhopisů, aby každý z dusíku a kyslíku dluhopisů, stejně jako formální náboj na každý atom kyslíku v hybridním lze snadno určit:
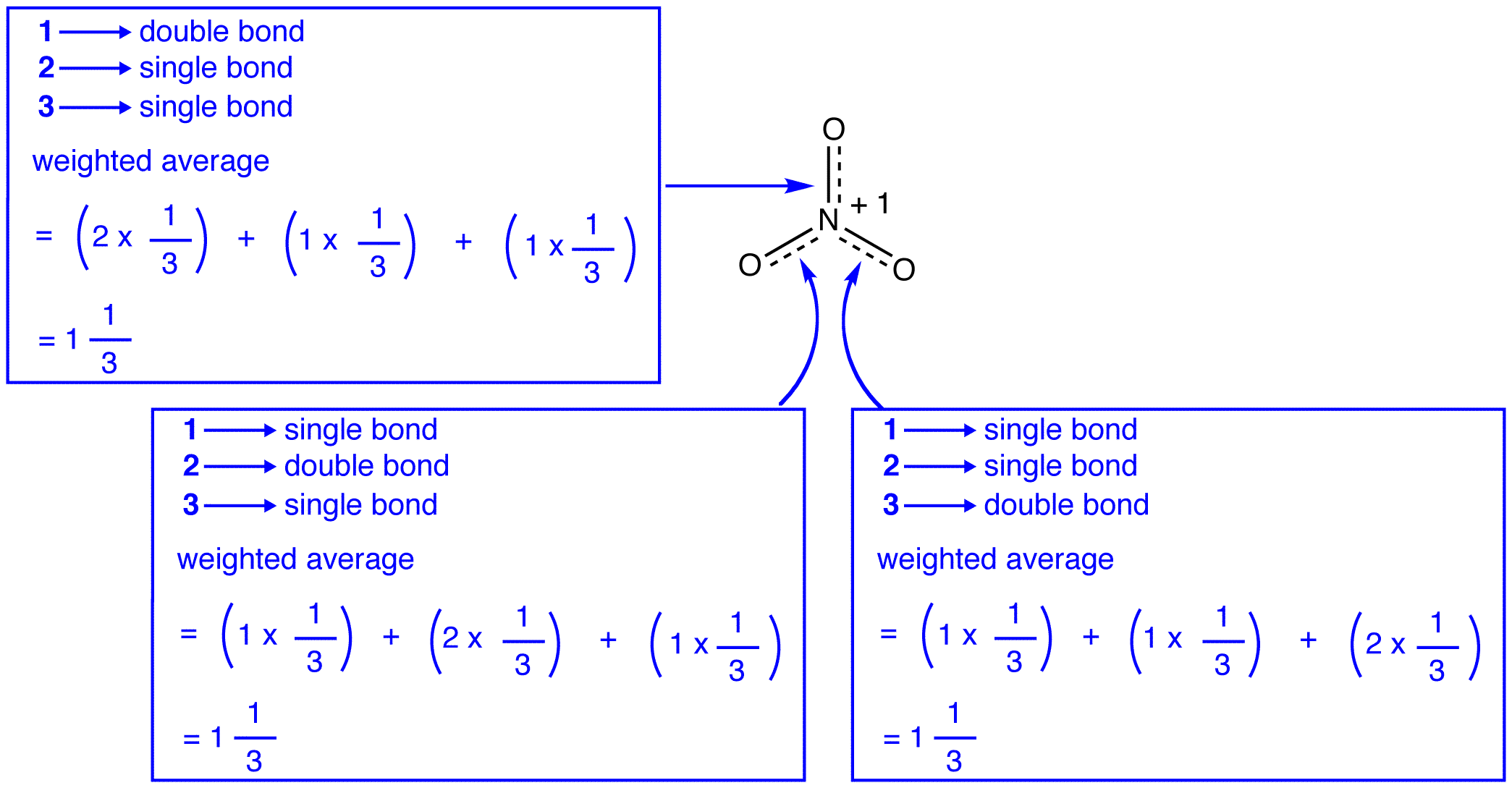
Podle teorii rezonance, každého dluhopisu ve dusičnanového iontu je jedna a jedna třetina z dluhopisů, což je v souladu s pozorováním, že tři dluhopisů v dusičnanového iontu mají stejné pouto délky a stejné vazebné energie.,
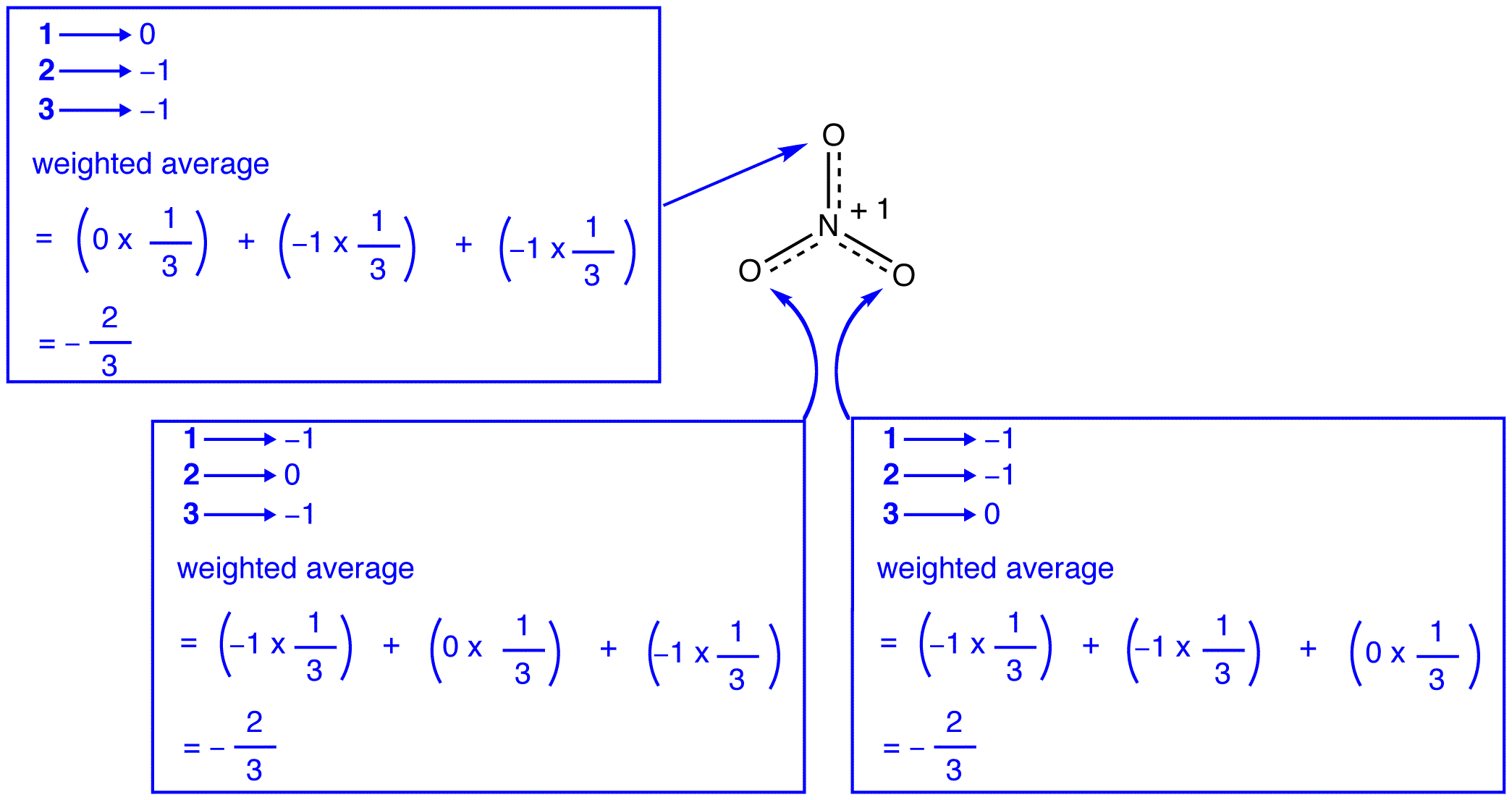
Podle teorii rezonance, každý atom kyslíku v dusičnanového iontu má formální náboj -2/3, což ve spojení s faktem, že tři dusíku a kyslíku dluhopisy jsou identické, je v souladu s pozorováním, že tři atomy kyslíku v dusičnanového iontu jsou k nerozeznání. V každé rezonanční formě dusičnanového iontu jsou dva\ (\pi\) elektrony a jsou sdíleny pouze dvěma atomy. Elektron sdílený pouze dvěma atomy se říká, že je lokalizován., Tak jsou lokalizovány dva\ (\pi\) elektrony v každé rezonanční formě dusičnanového iontu. Dusičnanů ion, reprezentované hybrid, má dvě \(\pi\) elektronů:
- # elektrony v jednom \(\pi\) vazba = 2
- # elektrony v jednom-třetina z \(\pi\) vazba = 2/3
- # elektrony ve třech z nich = 3 x (2/3) = 2
dva \(\pi\) elektrony v dusičnanového iontu jsou sdíleny celkem čtyři atomy, jeden atom dusíku a tří atomů kyslíku. Elektron sdílený více než dvěma atomy je údajně delokalizován. Takže dva\ (\pi\) elektrony v dusičnanovém iontu jsou delokalizovány., Přemístění výroby z \(\pi\) elektrony v dusičnanového iontu vyžaduje, aby čtyři atomy být na stejné rovině, což umožňuje boční překrytí p-orbitaly na ně.,

v Případě, že energie z dusičnanového iontu byly vážený průměr energií ze svých tří rezonance forem, stejně jako struktura dusičnanového iontu je váženým průměrem struktury jeho tři rezonanční formy, to by měla být rovna energii jednoho ze tří identických rezonance forem:

v Případě, že energie z hybridní byli rovnající se rezonanční formě, vzhledem k tomu, že všechny chemické entity (elementární částice, atomy, molekuly, atd.,) přirozeně mají tendenci být v nejnižším možném energetickém stavu, nebyla by žádná výhoda, aby dusičnanový iont existoval jako hybrid; mohl by jednoduše existovat jako rezonanční forma. Od dusičnanového iontu existuje jako hybrid, ne jako rezonance formě, lze vyvodit, že energie hybrid je nižší, než nějaké rezonance forem.

Podle teorie rezonance pak, že energie molekuly je nižší než nejnižší-energie rezonance formě., Od dusičnanového iontu má nižší energii, a proto je stabilnější než kterýkoli z jeho rezonance forem, dusičnanového iontu je prý stabilizovaný vzorec.
běžné mylné představy
mezi začínajícími studenty existují dvě mylné představy o rezonanční teorii, pravděpodobně kvůli doslovné interpretaci slova rezonance. Jsou popsány níže, jako příklad používají dusičnanový iont.
Mylná představa 1: dusičnanového iontu existuje jako rezonance formulář 1 na chvíli a pak změny rezonance podobě 2 nebo rezonance formuláři 3, který interconvert, nebo se vrátit k 1.,

struktura dusičnanového iontu není 1 ani 2, ani 3, ale hybridní a nemění se s časem, pokud probíhá reakce.
Mylná představa 2: vzorek dusičnanu iontů, v daném okamžiku, jeden-třetí iontů existovat jako rezonance formulář č. 1, další třetina jako rezonance formulář 2, a zbývající třetina jako rezonance forma 3.

Ve vzorku dusičnanu iontů, v daném okamžiku všechny ionty mají stejnou strukturu, což je hybrid.,
Muly a Nosorožce,
klasické analogie používá k objasnění těchto dvou mylných představ je mula (Morrison, R. T.; Boyd, r. n. Organic Chemistry, fifth edition, Allyn a Bacon: Boston, 1987, str. 373). Biologicky je mezek hybrid koně a osla. To neznamená, že mezek se na chvíli podobá koni a pak se změní, aby se podobal Oslu. Vzhled mule je kombinací koně a osla a nemění se s časem. Ani to neznamená, že ve stádu se některé mezky podobají koni a ostatní Oslu., Ve stádě mají všechny muly stejný vzhled, což je kombinace koně a osla. Slabinou této analogie je, že koně a osli existují, zatímco rezonanční formy jsou přísně hypotetické. Lepší analogie, citovaný v Morrison a Boyd, je nosorožec. Když vidíme nosorožce, dalo by se to popsat jako hybrid draka a jednorožce, dvě stvoření, která neexistují.