Lernziele
- Zustand, Hund ‚ s rule.
- Wenden Sie Hunds Regel auf die Füllung von Orbitalen an.
- Verwenden Sie Orbitalfülldiagramme, um die Positionen von Elektronen in einem Atom zu beschreiben.
Haben Sie sich jemals gefragt, was diese Lastbegrenzungszeichen auf einer Brücke bedeuten?
Das obige Zeichen besagt, dass nichts über fünf Tonnen erlaubt ist, da es die Struktur beschädigt., Es gibt Grenzen für das Gewicht, das eine Brücke tragen kann, es gibt Grenzen für die Anzahl der Personen, die einen Raum sicher einnehmen können, und es gibt Grenzen für das, was in ein Elektronenbital gehen kann.

Hund ‚ s Rule
Die letzte der drei Regeln für die Konstruktion von Elektronenanordnungen erfordert, dass Elektronen einzeln in einer Reihe von Orbitalen innerhalb derselben Unterebene platziert werden. Dies minimiert die natürlichen Abstoßungskräfte, die ein Elektron für ein anderes hat., Die Regel von Hund besagt, dass Orbitale gleicher Energie jeweils von einem Elektron besetzt sind, bevor ein Orbital von einem zweiten Elektron besetzt wird, und dass jedes der einzelnen Elektronen den gleichen Spin haben muss. Die folgende Abbildung zeigt, wie ein Satz von drei p-Orbitalen mit einem, zwei, drei und vier Elektronen gefüllt ist.
Orbitalfülldiagramme
Ein Orbitalfülldiagramm ist der visuellere Weg, um die Anordnung aller Elektronen in einem bestimmten Atom darzustellen., In einem Orbitalfülldiagramm werden die einzelnen Orbitale als Kreise (oder Quadrate) dargestellt und Orbitale innerhalb einer Unterebene horizontal nebeneinander gezeichnet. Jede Unterebene ist durch ihr Hauptenergieniveau und ihre Unterebene gekennzeichnet. Elektronen werden durch Pfeile innerhalb der Kreise angezeigt. Ein nach oben zeigender Pfeil zeigt eine Drehrichtung an, während ein nach unten zeigender Pfeil die andere Richtung anzeigt. Die Orbitalfülldiagramme für Wasserstoff, Helium und Lithium sind in Abbildung unten dargestellt.
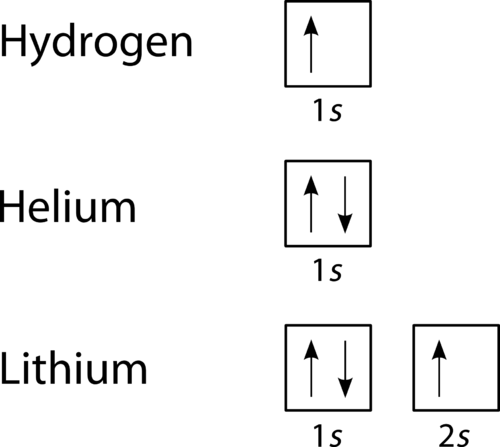
Abbildung 2., Orbitalfülldiagramme für Wasserstoff, Helium und Lithium.
Nach dem Aufbauprozess werden Unterebenen und Orbitale in der Reihenfolge zunehmender Energie mit Elektronen gefüllt. Da die s-Unterebene nur aus einem Orbital besteht, paart sich das zweite Elektron einfach mit dem ersten Elektron wie in Helium. Das nächste Element ist Lithium und erfordert die Verwendung der nächsten verfügbaren Unterebene, der 2s.
Das Fülldiagramm für Kohlenstoff ist in der folgenden Abbildung dargestellt. Es gibt zwei 2-p-Elektronen für Kohlenstoff und jeder nimmt sein eigenes 2-p-Orbital ein.,
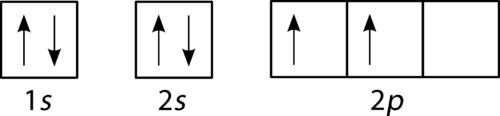
Abbildung 3. Orbitalfülldiagramm für Kohlenstoff.
Sauerstoff hat vier 2 p-Elektronen. Nachdem jedes 2-p-Orbital ein Elektron enthält, kann das vierte Elektron in das erste 2-p-Orbital mit einem Spin gegenüber dem des anderen Elektrons in diesem Orbital platziert werden.
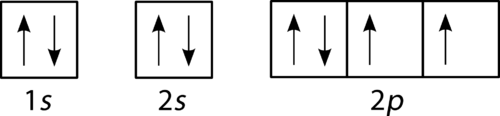
Abbildung 4. Orbitalfülldiagramm für Sauerstoff.
Zusammenfassung
- Hund s-Regel gibt die Reihenfolge der Elektronen-Füllung innerhalb einer Reihe von orbitalen.,
- Orbitale Fülldiagramme sind eine Möglichkeit, Elektronenpositionen in Orbitalen anzuzeigen.
Praxis
Verwenden Sie den folgenden Link, um die folgende Übung durchzuführen:
https://www.caymanchem.com/app/template/chemAssistant, Werkzeug.vm/itemid/4001
- Wählen Sie ein Atom aus der Liste aus (Sie möchten wahrscheinlich niedrigere Ordnungszahlen durchführen). Lassen Sie die Zahl eine Null setzen.
- Suchen Sie das Atom in einem Periodensystem nach und bestimmen Sie die Anzahl der vorhandenen Elektronen.
- Zeichnen Sie das Orbitalfülldiagramm für das Atom.,
- Klicken Sie auf die Schaltfläche „Berechnen“ und vergleichen Sie Ihre Antwort mit der angegebenen.
<
- Zustand Hund der regel.
- Was ist ein Orbitalfülldiagramm?
- Ist das Diagramm in der Abbildung unten korrekt? Erklären Sie Ihre Antwort.

- Ist das Diagramm in der folgenden Abbildung korrekt? Erklären Sie Ihre Antwort.,

<
- Hund ‚ s rule: Orbitale gleicher Energie werden jeweils von einem Elektron besetzt, bevor ein Orbital von einem zweiten Elektron besetzt wird und dass jedes der einzelnen Elektronen den gleichen Spin haben muss.
- Orbitalfülldiagramm: Eine visuelle Möglichkeit, die Anordnung aller Elektronen in einem bestimmten Atom darzustellen.