Lernziele
- Korrosion definieren
- Liste einiger Methoden auf, die verwendet werden, um Korrosion zu verhindern oder zu verlangsamen
Korrosion wird normalerweise als Abbau von Metallen aufgrund eines elektrochemischen Prozesses definiert. Die Rostbildung auf Eisen, das Anlaufen auf Silber und die blaugrüne Patina, die sich auf Kupfer entwickelt, sind Beispiele für Korrosion., Die Gesamtkosten für Korrosion in den Vereinigten Staaten sind erheblich, mit Schätzungen von mehr als einer halben Billion Dollar pro Jahr.
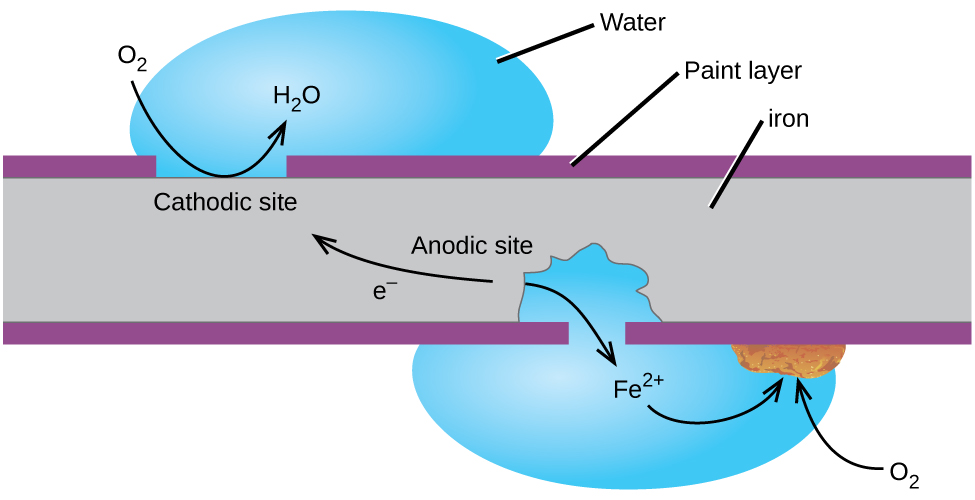
Das vielleicht bekannteste Beispiel für Korrosion ist die Rostbildung auf Eisen. Eisen rostet, wenn es Sauerstoff und Wasser ausgesetzt ist. Die Hauptschritte beim Rosten von Eisen scheinen Folgendes zu beinhalten (Abbildung 2). Sobald Eisen der Atmosphäre ausgesetzt ist, oxidiert es schnell.
Die Elektronen reduzieren Sauerstoff in der Luft in sauren Lösungen.
Was wir als Rost ist hydratisierten Eisen(III) – OXID, die entsteht, wenn Eisen(II) – Ionen reagieren weiter mit Sauerstoff.,
Die Anzahl der Wassermoleküle ist variabel, daher wird sie durch x dargestellt. Im Gegensatz zur Patina auf Kupfer bildet die Rostbildung keine Schutzschicht und so setzt sich die Korrosion des Eisens fort, wenn der Rost abblättert und frisches Eisen der Atmosphäre aussetzt.
Eine Möglichkeit, Eisen vor Korrosion zu schützen, besteht darin, es lackiert zu halten. Die Farbschicht verhindert, dass das für die Rostbildung notwendige Wasser und Sauerstoff mit dem Bügeleisen in Kontakt kommt. Solange die Farbe intakt bleibt, ist das Eisen vor Korrosion geschützt.,
Andere Strategien umfassen das Legieren des Eisens mit anderen Metallen. Zum Beispiel ist Edelstahl meist Eisen mit etwas Chrom. Das Chrom neigt dazu, sich in der Nähe der Oberfläche zu sammeln, wo es eine Oxidschicht bildet, die das Eisen schützt.
Verzinktes oder verzinktes Eisen verwendet eine andere Strategie. Zink wird leichter oxidiert als Eisen, da Zink ein geringeres Reduktionspotential hat. Da Zink ein geringeres Reduktionspotential hat, ist es ein aktiveres Metall. Selbst wenn die Zinkbeschichtung zerkratzt wird,oxidiert das Zink vor dem Eisen., Dies deutet darauf hin, dass dieser Ansatz mit anderen aktiven Metallen arbeiten sollte.
Ein weiterer wichtiger Weg zum Schutz von Metall besteht darin, es zur Kathode in einer galvanischen Zelle zu machen. Dies ist kathodischer Schutz und kann für andere Metalle als nur Eisen verwendet werden. Zum Beispiel kann das Rosten von unterirdischen Eisenspeichertanks und-rohren verhindert oder stark reduziert werden, indem sie mit einem aktiveren Metall wie Zink oder Magnesium verbunden werden (Abbildung 3). Dies wird auch verwendet, um die Metallteile in Warmwasserbereitern zu schützen., Die aktiveren Metalle (niedrigeres Reduktionspotential) werden Opferanoden genannt, da sie beim Korrodieren (Oxidieren) an der Anode verbraucht werden. Das zu schützende Metall dient als Kathode und oxidiert daher nicht (korrodiert). Wenn die Anoden ordnungsgemäß überwacht und regelmäßig ausgetauscht werden, kann die Nutzungsdauer des Eisenspeichers erheblich verlängert werden.
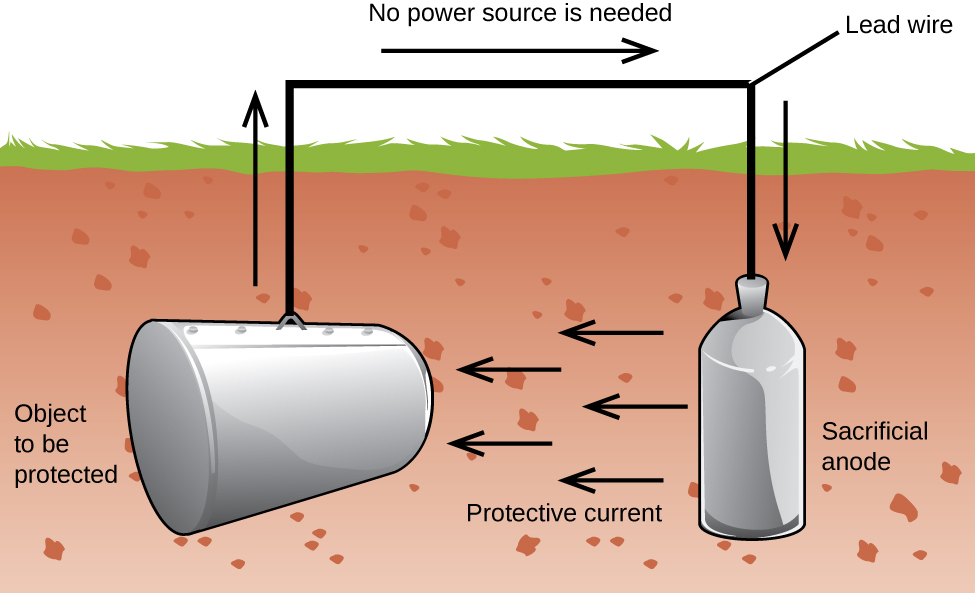
Korrosion ist der Abbau eines Metalls, der durch einen elektrochemischen Prozess verursacht wird. Jedes Jahr werden große Geldsummen ausgegeben, um die Auswirkungen von Korrosion zu reparieren oder zu verhindern. Einige Metalle wie Aluminium und Kupfer bilden eine Schutzschicht, wenn sie an der Luft korrodieren., Die dünne Schicht, die sich auf der Oberfläche des Metalls bildet, verhindert, dass Sauerstoff mit mehr Metallatomen in Kontakt kommt, und „schützt“ so das verbleibende Metall vor weiterer Korrosion. Eisen korrodiert (bildet Rost), wenn es Wasser und Sauerstoff ausgesetzt wird. Der Rost, der sich auf Eisenmetall bildet, blättert ab und setzt frisches Metall frei, das ebenfalls korrodiert. Eine Möglichkeit, Korrosion zu verhindern oder zu verlangsamen, besteht darin, das Metall zu beschichten. Die Beschichtung verhindert, dass Wasser und Sauerstoff das Metall berühren. Farbe oder andere Beschichtungen verlangsamen die Korrosion, sind jedoch nach dem Verkratzen nicht wirksam., Verzinktes oder verzinktes Eisen nutzt die Tatsache aus, dass Zink eher oxidiert als Eisen. Solange die Beschichtung erhalten bleibt, oxidiert das Zink, selbst wenn es zerkratzt wird, vor dem Eisen. Eine andere Methode zum Schutz von Metallen ist der kathodische Schutz. Bei diesem Verfahren wird ein leicht oxidiertes und kostengünstiges Metall, oft Zink oder Magnesium (die Opferanode), elektrisch mit dem Metall verbunden, das geschützt werden muss. Das aktivere Metall ist die Opferanode und die Anode in einer galvanischen Zelle. Das „geschützte“ Metall ist die Kathode und bleibt nicht oxidiert., Ein Vorteil des kathodischen Schutzes besteht darin, dass die Opferanode bei Bedarf überwacht und ausgetauscht werden kann.,
Glossar
kathodische Schutzmethode zum Schutz von Metall unter Verwendung einer Opferanode und zur wirksamen Herstellung des Metalls, das den Schutz der Kathode benötigt, wodurch dessen Oxidation verhindert wird Korrosionsabbau von Metall durch einen elektrochemischen Prozess verzinktes Eisenverfahren zum Schutz von Eisen durch Abdecken mit Zink, das vor dem Eisen oxidiert; verzinkte Eisenopferanode aktiveres, kostengünstigeres Metall, das als Anode im kathodischen Schutz verwendet wird; häufig aus Magnesium oder Zink hergestellt
Antworten zur Chemie Ende des Kapitels Übungen
p>
2., Mg-und Zn –
4. Beide Beispiele beinhalten kathodischen Schutz. Die (Opfer -) Anode ist das Metall, das korrodiert (oxidiert oder reagiert). Bei Eisen (-0,447 V) und Zink (-0,7618 V) weist Zink ein negativeres Standardreduktionspotential auf und dient so als Anode. Bei Eisen und Kupfer (0,34 V) hat Eisen das geringere Standardreduktionspotential und korrodiert so (dient als Anode).
6., Während das Reduktionspotential von Lithium es in der Lage machen würde, die anderen Metalle zu schützen, ist dieses hohe Potenzial auch ein Hinweis darauf, wie reaktiv Lithium ist; es würde eine spontane Reaktion mit den meisten Substanzen haben. Dies bedeutet, dass das Lithium schnell mit anderen Substanzen reagieren würde, auch mit solchen, die das Metall, das es zu schützen versucht, nicht oxidieren würden. Reaktivität wie diese bedeutet, dass die Opferanode schnell erschöpft wäre und häufig ersetzt werden müsste. (Optional zusätzlicher Grund: Brandgefahr in Gegenwart von Wasser.)