Die Brønsted-Lowry-Theorie von Säuren und Basen
Brønsted-Lowry-Theorie von Säure und Basen ging die Arrhenius-Definition noch einen Schritt weiter, da ein Stoff nicht mehr aus Wasserstoff (H+) – oder Hydroxid (OH -) – Ionen bestehen musste, um als Säure oder Base klassifiziert zu werden. Betrachten Sie für exmapl die folgende chemische Gleichung:
\
- Eine Brønsted-Lowry-Säure ist ein Protonen – (Wasserstoffionen -) Donor.
- Eine Brønsted-Lowry-Base ist ein Protonen (Wasserstoffionen) – Akzeptor.,
In dieser Theorie ist eine Säure eine Substanz, die ein Proton freisetzen kann (wie in der Arrhenius-Theorie), und eine Base ist eine Substanz, die ein Proton aufnehmen kann., Ein basisches Salz, wie Na+F-, erzeugt OH – Ionen in Wasser, indem Protonen aus dem Wasser selbst entnommen werden (um HF zu erzeugen):
\
- Säuredissoziation
\
- Säuredionisationskonstante:
\}{}\]
- Basendissoziation:
\
- Basenionisationskonstante
\}{}\]
Die Bestimmung eines Stoffes als Brønsted-Lowery-Säure oder Base kann nur durch Beobachtung der Reaktion erfolgen. Im Falle des HOH ist es im ersten Fall eine Base und im zweiten Fall eine Säure.,
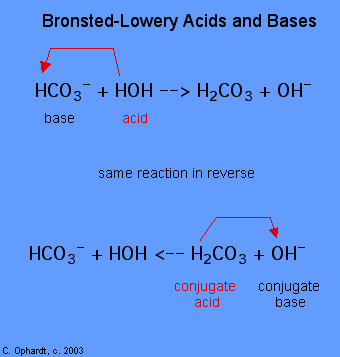
Um festzustellen, ob eine Substanz eine Säure oder eine Base ist, zählen Sie die Hydrogene auf jeder Substanz vor und nach der Reaktion. Wenn die Anzahl der Hydrogene abgenommen hat, ist diese Substanz die Säure (spendet Wasserstoffionen). Wenn die Anzahl der Hydrogene zugenommen hat, ist diese Substanz die Base (akzeptiert Wasserstoffionen). Diese Definitionen werden normalerweise auf die Reaktanten auf der linken Seite angewendet. Wenn die Reaktion umgekehrt betrachtet wird, kann eine neue Säure und Base identifiziert werden., Die Substanzen auf der rechten Seite der Gleichung heißen Konjugatsäure und Konjugatbasis im Vergleich zu denen auf der linken Seite. Beachten Sie auch, dass sich die ursprüngliche Säure nach Beendigung der Reaktion in der Konjugatbasis dreht.
Hinweis
Säuren sind Protonenspender und Basen Protonenakzeptoren
Damit eine Reaktion im Gleichgewicht ist, muss eine Übertragung von Elektronen erfolgen. Die Säure gibt ein Elektron ab und die Base erhält das Elektron. Säuren und Basen, die auf diese Weise zusammenarbeiten, werden als Konjugatpaar bezeichnet, das aus Konjugatsäuren und Konjugatbasen besteht.,
\
A steht für eine saure Verbindung und Z steht für eine basische Verbindung
- A spendet H an HZ+.
- Z Nimmt H von A an, das HZ+
- A bildet-wird konjugierte Base von HA und in der umgekehrten Reaktion akzeptiert es ein H von HZ, um HA wieder herzustellen, um im Gleichgewicht zu bleiben
- HZ+ wird eine konjugierte Säure von Z und in der umgekehrten Reaktion spendet es ein H an A-rekonstruierendes Z, um im Gleichgewicht zu bleiben