Vorhersage von SN1-vs. SN2-Mechanismen
Wenn man bedenkt, ob eine nukleophile Substitution wahrscheinlich über einen SN1-oder SN2-Mechanismus auftritt, müssen wir wirklich drei Faktoren berücksichtigen:
1) Das Elektrophil: Wenn die Proteingruppe an eine Methylgruppe oder einen Primärkohlenstoff gebunden ist, wird ein SN2-Mechanismus bevorzugt (hier ist das Elektrophil und jeder Carbocation-Zwischenstopp wäre energiereich und daher unwahrscheinlich)., Wenn die Leaving-Gruppe an einen tertiären, Allyl-oder Benzylic-Kohlenstoff gebunden ist, wird ein Carbocation-Zwischenprodukt relativ stabil sein und somit wird ein SN1-Mechanismus begünstigt. Diese Muster der Reaktivität von unten zusammengefasst.,yl Halogenid Struktur
2) Das Nucleophile: starke Nucleophile, insbesondere solche mit negativen Ladungen, begünstigen die SN2-Mechanismus., Schwächere Nukleophile wie Wasser oder Alkohole begünstigen den SN1-Mechanismus.
3) Das Lösungsmittel: Polare aprotische Lösungsmittel begünstigen den SN2-Mechanismus, indem sie die Reaktivität des Nukleophilen erhöhen. Polare protische Lösungsmittel begünstigen den SN1-Mechanismus, indem sie den Übergangszustand und das Carbokationszwischenprodukt stabilisieren. SN1-Reaktionen werden Solvolyse-Reaktionen genannt, wenn das Lösungsmittel das Nukleophile ist.
Diese Reaktivitätsmuster sind in der nachstehenden Tabelle zusammengefasst.,>
Die folgende Reaktion weist beispielsweise ein tertiäres Alkylbromid als Elektrophil, ein schwaches nukleophiles und ein polares protisches Lösungsmittel auf (wir gehen davon aus, dass Methanol das Lösungsmittel ist)., So würden wir zuversichtlich einen SN1-Reaktionsmechanismus vorhersagen. Da Substitution bei einem chiralen Kohlenstoff auftritt, können wir auch vorhersagen, dass die Reaktion mit Racemisierung fortfahren wird.

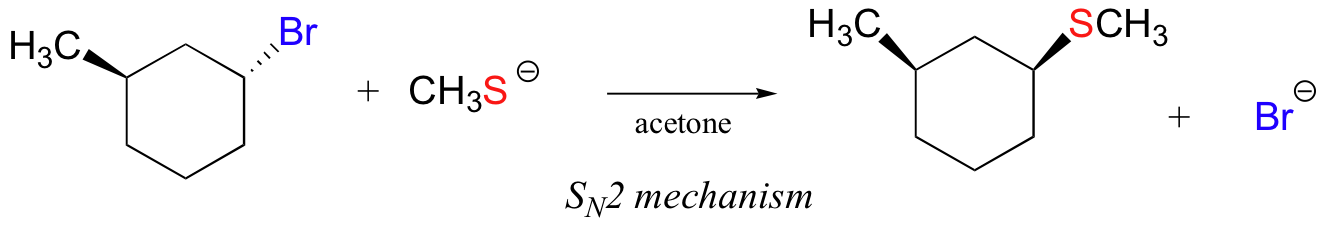
In der folgenden Reaktion ist das Elektrophil dagegen ein Sekundäralkylbromid – mit diesen sind sowohl SN1-als auch SN2-Mechanismen möglich, abhängig vom Nucleophilen und dem Lösungsmittel. In diesem Beispiel ist das nukleophile (ein Thiolatanion) stark, und ein polares protisches Lösungsmittel wird verwendet – so wird der SN2-Mechanismus stark bevorzugt., Es wird erwartet, dass die Reaktion mit einer Inversion der Konfiguration fortschreitet.
Übung
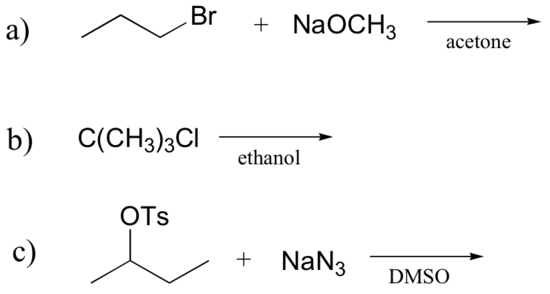
1. Bestimmen Sie, ob jede Substitutionsreaktion, die unten gezeigt wird, wahrscheinlich durch einen SN1-oder SN2-Mechanismus abläuft, und erläutern Sie Ihre Argumentation.
Antwort
a) SN2 b/c Primäralkylhalogenid mit einem starken Nucleophilen in einem polaren aprotischen Lösungsmittel.
b) SN1 b / c tertiäres Alkylhalogenid mit einem schwachen Nucleophilen, das auch das Lösungsmittel ist (Solvolyse).,
c) SN2 b / c sekundäre Alkylhalogenide begünstigen diesen Mechanismus, wenn sie mit einem starken Nukleophilen (und einer schwachen Base) in einem polaren aprotischen Lösungsmittel reagiert werden.