Die Beziehung zwischen Druck und Volumen: Boyle ‚ s Law
Wie der Druck auf ein gas erhöht, das Volumen des Gases verringert sich, da sich die gasteilchen sind gezwungen, näher zusammen. Umgekehrt nimmt mit abnehmendem Druck auf ein Gas das Gasvolumen zu, da sich die Gaspartikel nun weiter auseinander bewegen können., Wetterballons werden größer, wenn sie durch die Atmosphäre zu Regionen mit niedrigerem Druck aufsteigen, weil das Volumen des Gases zugenommen hat; Das heißt, das atmosphärische Gas übt weniger Druck auf die Oberfläche des Ballons aus, so dass sich das innere Gas ausdehnt, bis der innere und der äußere Druck gleich sind.
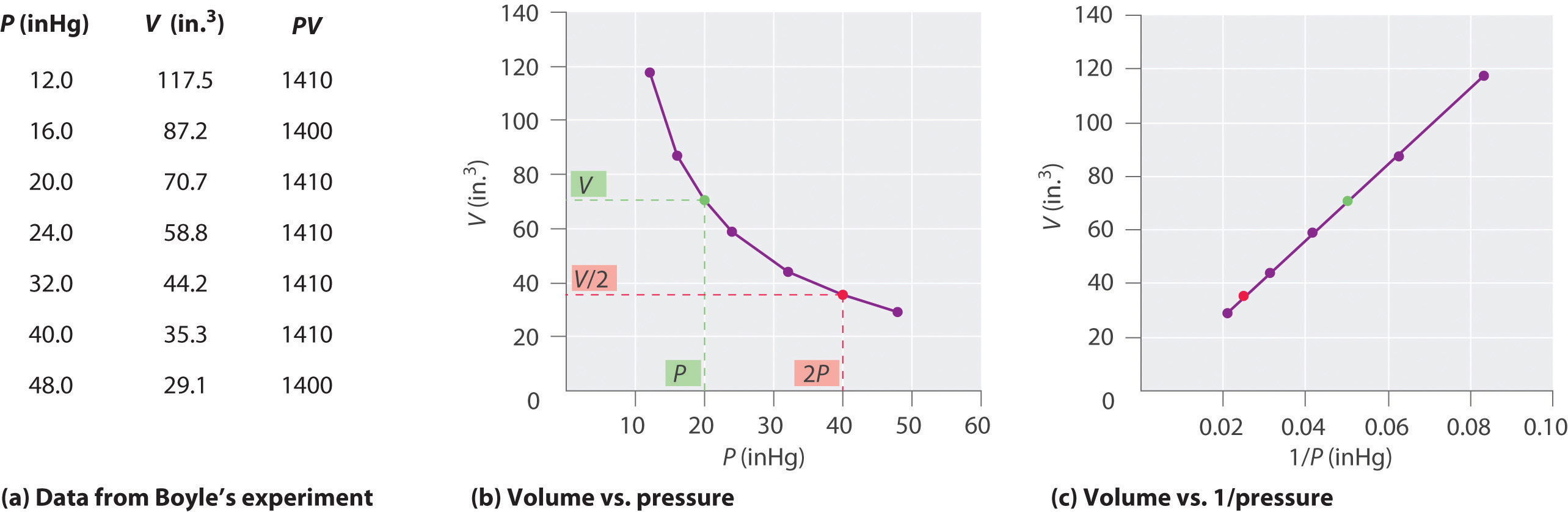
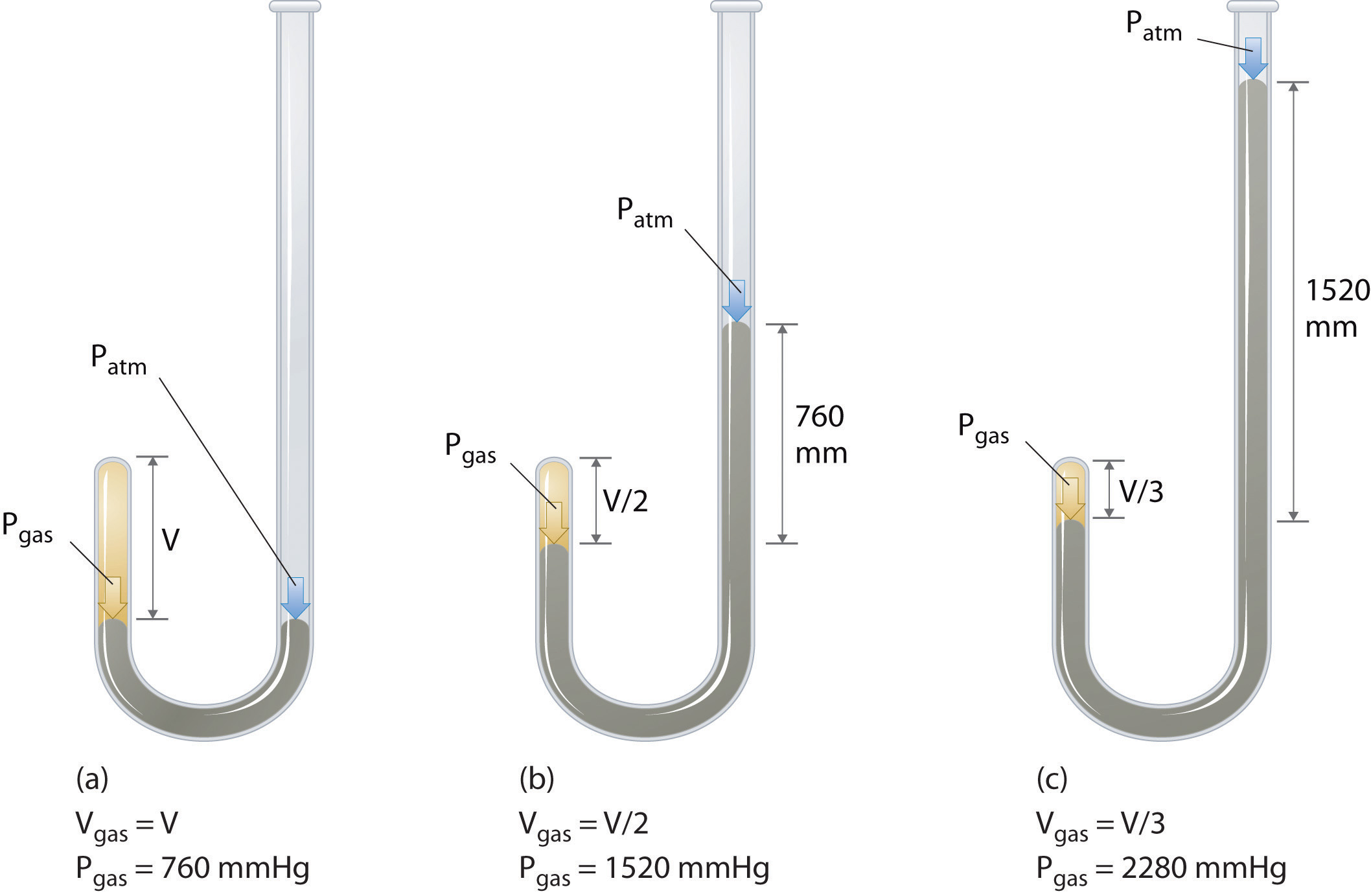
Der irische Chemiker Robert Boyle (1627-1691) führte einige der frühesten Experimente durch, die die quantitative Beziehung zwischen dem Druck und dem Volumen eines Gases bestimmten. Boyle verwendete ein J-förmiges Rohr, das teilweise mit Quecksilber gefüllt war, wie in Abbildung \(\pageIndex{1}\) gezeigt., In diesen Experimenten wird eine kleine Menge eines Gases oder einer Luft über der Quecksilbersäule eingeschlossen, und sein Volumen wird bei Atmosphärendruck und konstanter Temperatur gemessen. Mehr Quecksilber wird dann in den offenen Arm gegossen, um den Druck auf die Gasprobe zu erhöhen. Der Druck auf das Gas ist Atmosphärendruck plus die Höhendifferenz der Quecksilbersäulen, und das resultierende Volumen wird gemessen. Dieser Vorgang wird wiederholt, bis entweder kein Platz mehr im offenen Arm mehr vorhanden ist oder das Volumen des Gases zu klein ist, um genau gemessen zu werden., Daten, wie sie aus Boyles eigenen Experimenten stammen, können auf verschiedene Arten dargestellt werden (Abbildung \(\pageIndex{2}\)). Ein einfaches Diagramm von \(V\) gegenüber \(P\) ergibt eine Kurve, die Hyperbel genannt wird, und zeigt eine umgekehrte Beziehung zwischen Druck und Volumen: Wenn der Druck verdoppelt wird, nimmt das Volumen um den Faktor zwei ab. Diese Beziehung zwischen den beiden Größen wird wie folgt beschrieben:
\
Das Teilen beider Seiten durch \(P\) ergibt eine Gleichung, die die umgekehrte Beziehung zwischen \(P\) und \(V\) veranschaulicht:
\
oder
\
wobei das ∝ – Symbol gelesen wird “ proportional zu.“Ein Diagramm von V gegenüber 1 / P ist somit eine gerade Linie, deren Steigung gleich der Konstante in Gleichung 6.2.1 und Gleichung 6.2.3 ist. Das Teilen beider Seiten der Gleichung 6.2.1 durch V anstelle von P ergibt eine ähnliche Beziehung zwischen P und 1 / V., Der numerische Wert der Konstante hängt von der im Experiment verwendeten Gasmenge und von der Temperatur ab, bei der die Experimente durchgeführt werden. Diese Beziehung zwischen Druck und Volumen wird nach seinem Entdecker als Boyles Gesetz bezeichnet und kann wie folgt angegeben werden: Bei konstanter Temperatur ist das Volumen einer festen Menge eines Gases umgekehrt proportional zu seinem Druck.